1. Batteridilemmaet – udfordringer og løsninger
Forestil dig, at du en dag ikke kan lade din mobil eller computer op. Eller at elbilerne ikke kan køre længere. Eller at du ikke kan få skiftet batteriet i din cykellygte, og at dine forældres elcykel ikke længere kan køre. Det lyder bestemt ikke rart, men det kan blive virkelighed, for flere af de ressourcer, der skal til for at lave batterier, er ved at slippe op. Desuden resulterer politiske beslutninger, korruption og dårlig økonomi i, at folk dag ud og dag ind knokler under vanskelige og farlige forhold i tredje verdenslande for at skaffe mineraler til din næste mobiltelefon. Er vi ved at løbe tør for batterier? Se DRs explainer om emnet.
udgravning af mineraler til batteriet i din mobiltelefon og i folks elbiler har store konsekvenser for dem, der arbejder i minerne i Den Demokratiske Republik Congo? Pricille er en af mange, der arbejder i minerne, og hun aborterede to gange og udtaler: ’Here it is better not to be born!’

Her er der et indlysende dilemma! I dag er batterier helt uundværlige i vores dagligdag, og de spiller en stor rolle i den grønne omstilling, fordi de kan bruges til at lagre f.eks. overskudsenergi fra vindmøller og solfangere. Og vi er allerede langt, da mange batterier efterhånden er genopladelige. Men i de mest anvendte batterier i dag er der brug for sjældne eller vanskeligt tilgængelige grundstoffer, som har store personlige omkostninger for dem, der graver dem ud. Skal vi droppe vores mobiler? Og bør vi glemme alt om den grønne omstilling til vedvarende energi? NEJ! Selvfølgelig ikke!
Der er i stedet brug for nye typer batterier for at sikre den grønne omstilling. Og dem er forskere heldigvis godt i gang med at udvikle! Vi skal bruge grundstoffer, der findes i rigelige mængder og som findes i vores nærområder, så vi hverken belaster fattige mennesker eller miljøet. Og så skal du nok kunne lade mobilen og computeren op, og du skal nok kunne komme omkring på elcykel eller i elbil. Kemikere spiller en afgørende rolle i at udvikle batterier med miljømæssigt bedre grundstoffer, men nogle er for tunge, og andre har ikke de rette kemiske egenskaber.
Og hvis DU også vil spille en rolle i at sætte fokus på dette dilemma, så kan DIT første skridt være, at du lærer om, hvordan batterier fungerer, så du kan tage kritisk stilling til, hvilke batterier du fremover vil bruge. Et andet skridt for dig kan være at tage en nuanceret og aktiv del i diskussioner om brug af batterier ude i samfundet og forklare andre, hvad dilemmaet drejer sig om.
I ’ Fremtidens batterier ’ lærer du meget af den kemi, der danner grundlaget for at udvikle fremtidens batterier, f.eks. den del af kemien der omhandler redoxreaktioner. Du skal også selv lave dit eget batteri og være med til at identificere grundstoffer, der kan tænkes at være gode i fremtidens batterier. Først skal du møde en af flere batteriforskere i Danmark.
Hvordan kan kemi gøre batterier bedre og grønnere?

Dorthe Ravnsbæk er professor i noget, der hedder materialekemi. Hun og hendes forskningsgruppe fra Institut for Kemi på Aarhus Universitet er en af mange forskergrupper i Danmark, der arbejder på at udvikle nye materialer til batterier, der både er bedre, billigere og mere sikre. Samtidig skal de være bæredygtige både når de produceres og når de skal genbruges eller bortskaffes. Dorthe udtaler:
”Batterier er en helt central del af den grønne omstilling. Desværre er mange af de hyppigst brugte batterier, som f.eks. lithiumionbatterier, baseret på kritiske råstoffer. Fra 2020 til 2023 er prisen på lithium blevet 8 gange højere, hvilket er en god indikator på, at den stigende efterspørgsel har ført til en knaphed på lithium. Brugen af de kritiske råstoffer er med andre ord ikke bæredygtige, og da de ofte bliver leveret af lande, som vi i Danmark ikke vil være afhængige af, så opstår der en kæmpe udfordring.”
Dorthe fortsætter: ”For at kunne løse den truende batterikrise, arbejder vi derfor som materialeforskere på at udvikle teknologier, der bygger på materialer, som er almindeligt forekommende og kan skaffes og bortskaffes på bæredygtig vis. Og for at kunne dette er vi nødt til at have et kendskab både til helt basal redoxkemi, el-lære fra fysik samt stoffers struktur og egenskaber.”
Dorthe arbejder med at forstå atomstrukturen i batterimaterialer. Oftest er dette krystallinsk og har en opbygning, der minder om iongitteret i fx natriumchlorid. Her fortsætter krystalstrukturen i mønsteret med skiftevis natrium- og chloridioner holdt sammen af ionbindinger (vist med sorte streger mellem de farvede kugler i figur 2a). I et genopladeligt lithiumionbatteri bevares krystalstrukturen i princippet både ved brug og genopladning, og det burde derfor kunne bruges og genoplades uendeligt mange gange (figur 2b). Men når batterier bruges, ændres krystalstrukturen i dem både ved brug og genopladning (figur 2c). Ændringerne har stor betydning for, hvor godt batteriet fungerer, og i nogle tilfælde går krystalstrukturen i stykker på måder, der betyder, at batteriet virker dårligere og dårligere. Men underligt nok ødelægges krystalstrukturen ikke altid. Derfor arbejder Dorthe på at forstå, hvad der sker på atomniveau. Med den viden kan man så arbejde på at undgå, at batterierne går i stykker, så de kan genoplades mange flere gange.
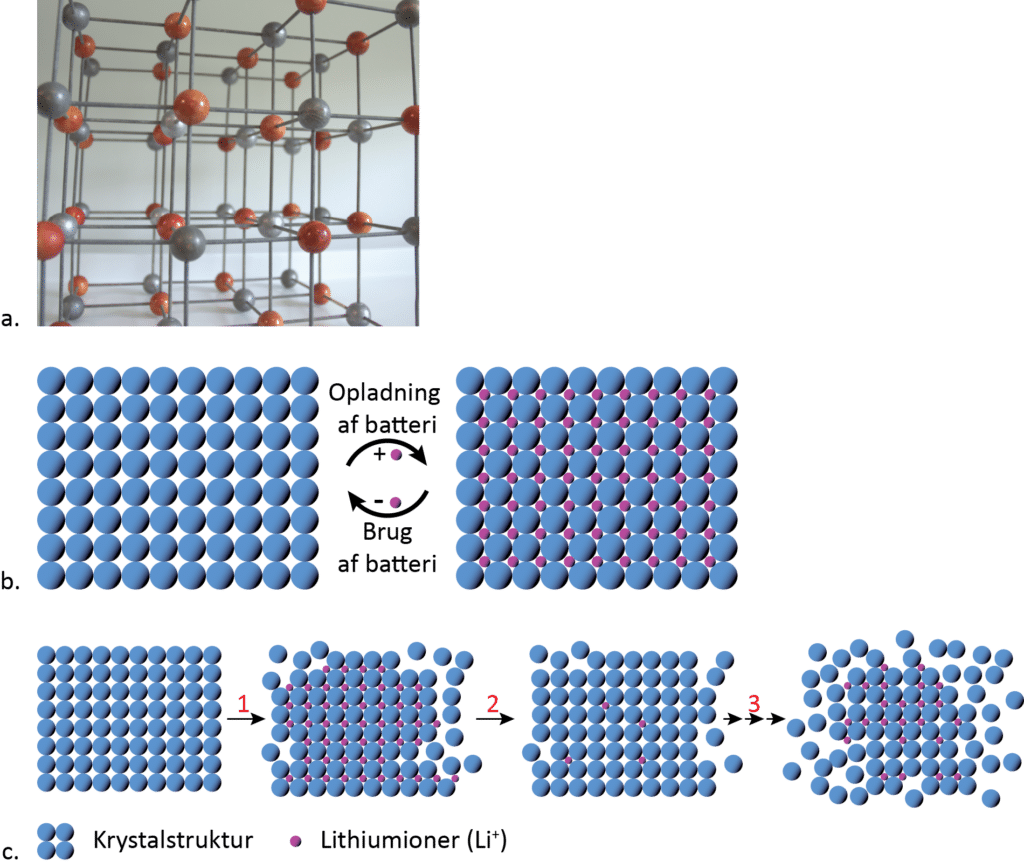
Når Dorthe undersøger batterierne, arbejder hun i krydsfeltet mellem kemi og fysik. Hun kigger på dem på mange størrelsesniveauer helt fra makrostrukturen, når man åbner batteriet, til mikroskala, nanoskala og atomskala, hvor hun bl.a. bruger teknikken røntgendiffraktion til at ”se” atomerne.
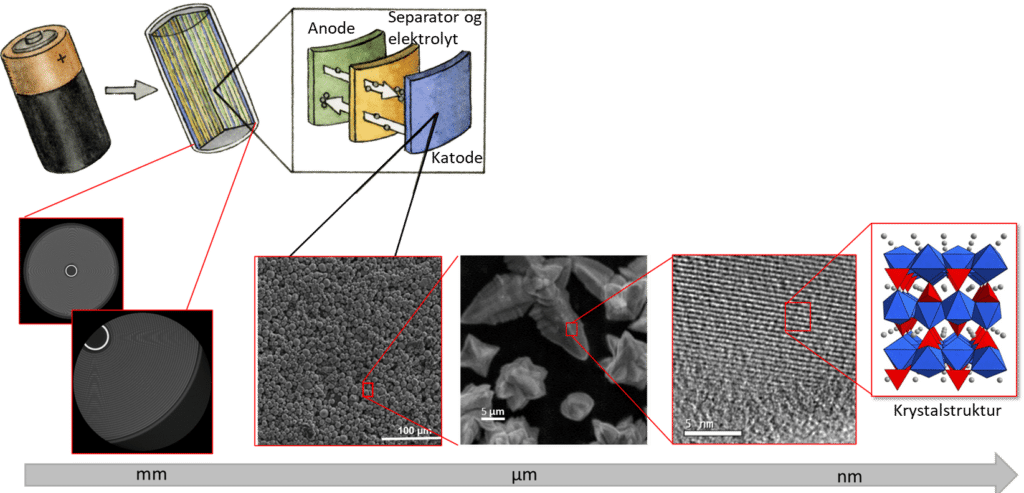
Vi vender tilbage til Dorthe og hendes forskning, når teorien bag kemien i batterier er blevet gennemgået.
Se mere
Et elektrisk batteri, som du kender det fra netop mobiltelefoner og lommelygter, er en energikilde. Dvs. at det lagrer energi, der kan omdannes til strøm, som så bruges til elektriske apparater uden de er tilsluttet til en stikkontakt. Energien er lagret i de kemiske forbindelser i batterierne.
Nogle af de største videnskabsmænd i det 18. århundrede havde en stor betydning for udviklingen af og forståelsen for, hvordan et batteri virker. Af disse var det Alessandro Volta, som byggede det første batteri, der minder om, hvordan nutidens batterier er opbygget. Hans batteri bestod skiftevis af zink- og kobberplader adskilt af papstykker fugtet med saltvand og svovlsyre (se figur 4). Før vi dykker ned i de kemiske reaktioner i moderne batterier, skal vi lige forstå opbygningen af Voltas batteri, og hvordan det virker.
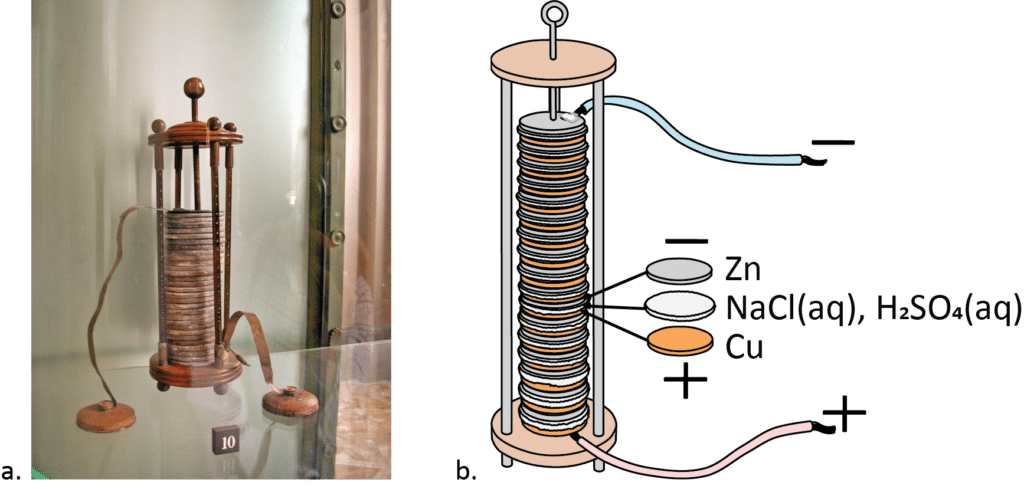
2. Hvordan virker et batteri?
Batterier kan have mange former, men der er altid en katode (den positive pol) og en anode (den negative pol), som ikke er i direkte kontakt med hinanden, da der er et materiale imellem disse, som kaldes for elektrolytten.
Når batterier er tilsluttet et eksternt, elektrisk kredsløb, sker der en bevægelse af elektroner i kredsløbet. Samtidig sker der faktisk også en tilsvarende bevægelse af ioner inden i et batteri. Materialer, hvor ioner kan bevæge sig igennem, kaldes ionisk ledende materialer. Katoden og anoden i batterier består af et materiale, som er både elektrisk ledende og ionisk ledende, mens det mellemliggende materiale, elektrolytten, der isolerer anoden og katoden fra hinanden, kun er ionisk ledende. Hvis det var elektrisk ledende, ville batteriet kortslutte, og hvis det sker ved en fejl, kan det have drastiske konsekvenser.
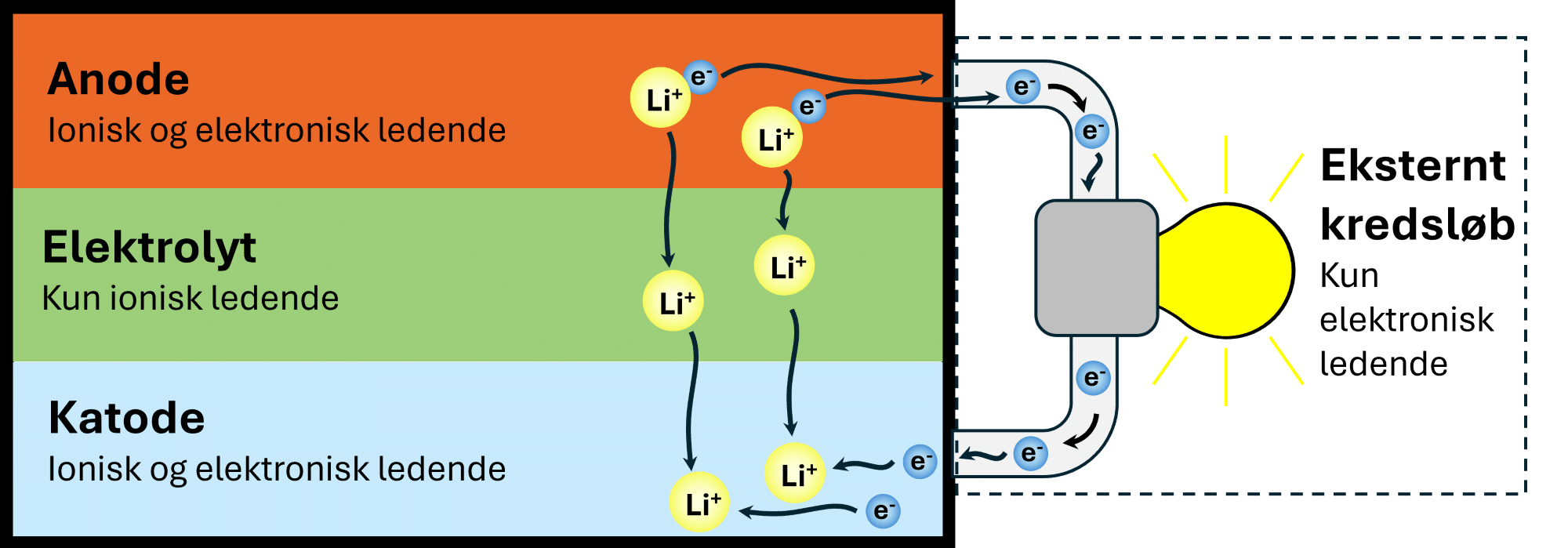
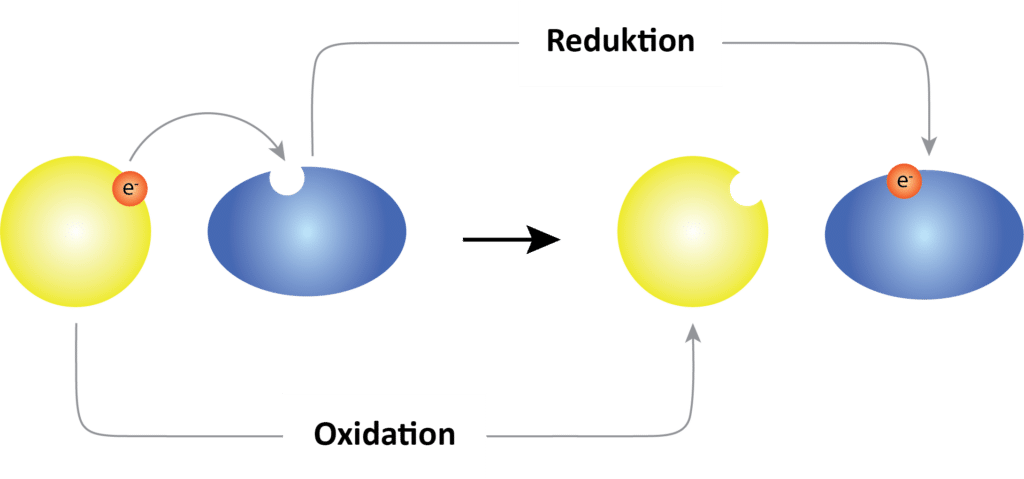
I figur 5 ses, hvordan lithiumatomet inden i lithiumionbatteriet, som er en af de mest anvendte batterityper, afgiver elektroner til det eksterne, elektriske kredsløb. Når et stof afgiver elektroner, siger man, at det oxideres. Herefter bevæger ionerne sig fra anoden gennem en elektrolyt og hen til katoden, hvor ionerne modtager elektronerne igen. Når et stof modtager elektroner, siger man, at det reduceres. Når batteriet er i brug, sker der en afladning af det, og oxidationen sker ved anoden, mens reduktionen sker ved katoden.
Når lithiumatomer oxideres i vandig opløsning, afgiver det en enkelt elektron og bliver til en lithiumion (se figur 5), dvs. reaktionen ser således ud:
Li(s) → Li+(aq) + e–
(1)
Dette kaldes for en delreaktion, da en elektron ikke kan eksistere alene.
De kemiske reaktioner i et batteri kendte Alessandro Volta ikke. Nu ved vi, at der er tale om reaktioner, der kaldes oxidationsreaktioner og reduktionsreaktioner – til sammen kaldes det redoxreaktioner (se figur 6).
Stil jer i to mindre cirkler. I skal starte med at have en bold pr. cirkel, men I kan prøve at gå op til 2 bolde. Bolden simulerer en elektron, og da elektroner ikke kan eksistere alene, må den ikke røre gulvet. En person starter med at have bolden, og idet personen kaster den til en tilfældig anden person, siger vedkommende ordet ”oxidation” højt. Den person, der griber bolden, siger ”reduktion” højt. Sådan fortsætter I i to minutter, mens I kaster bolden hurtigere og hurtigere. Hvis I bytter om på fagudtrykkene, starter I forfra. Den cirkel, som først kommer igennem 2 minutter uden fejl, vinder. Måske kan I bruge huskereglen: Den som redder bolden fra at falde på jorden, reduceres.
Stil jer i to mindre cirkler. I skal starte med at have en bold pr. cirkel, men I kan prøve at gå op til 2 bolde. Bolden simulerer en elektron, og da elektroner ikke kan eksistere alene, må den ikke røre gulvet. En person starter med at have bolden, og idet personen kaster den til en tilfældig anden person, siger vedkommende ordet ”oxidation” højt. Den person, der griber bolden, siger ”reduktion” højt. Sådan fortsætter I i to minutter, mens I kaster bolden hurtigere og hurtigere. Hvis I bytter om på fagudtrykkene, starter I forfra. Den cirkel, som først kommer igennem 2 minutter uden fejl, vinder. Måske kan I bruge huskereglen: Den som redder bolden fra at falde på jorden, reduceres.
Se mere
Nu skulle du gerne have styr på definitionen på en redoxreaktion. Lad os prøve at få styr på, hvilke redoxreaktioner der sker i et batteri.
I batterier bevæger ioner sig fra anoden til katoden, mens de sender elektroner ud i det ydre kredsløb. Her modtager ionerne elektroner igen. De kemiske reaktioner i batterier er derfor redoxreaktioner, som handler om overførsler af elektroner.
Kemi og fysik hænger sammen
Du er måske tidligere stødt på elektriske kredsløb i fysik-kemi-undervisningen. Dette er et emne, der i gymnasiet hører til i fysikundervisningen, men i forsøget nedenfor bruges faktisk noget viden fra fysik, selvom det ikke umiddelbart er indlysende. Ledningen, hvor elektronerne løber, er lavet af metalatomer, og metalatomerne sidder i et metalgitter og er bundet sammen med såkaldte metalbindinger. Det er en type af kemisk binding, hvor elektronerne i den yderste skal i metalatomerne, sidder ’løst nok’ til, at de deles med andre metalatomer (man kalder det, at elektronerne er delokaliserede). Se denne engelske video om metalbindinger og legeringer (alloys).
Når elektronerne forlader anoden i et batteri for at gå igennem det eksterne, elektriske kredsløb (se figur 5), er det ikke de samme elektroner, der ankommer til batteriets katode. Elektroner kommer ind i batteriet i den ene ende, og der skubbes andre ud i den anden ende (se figur 7).
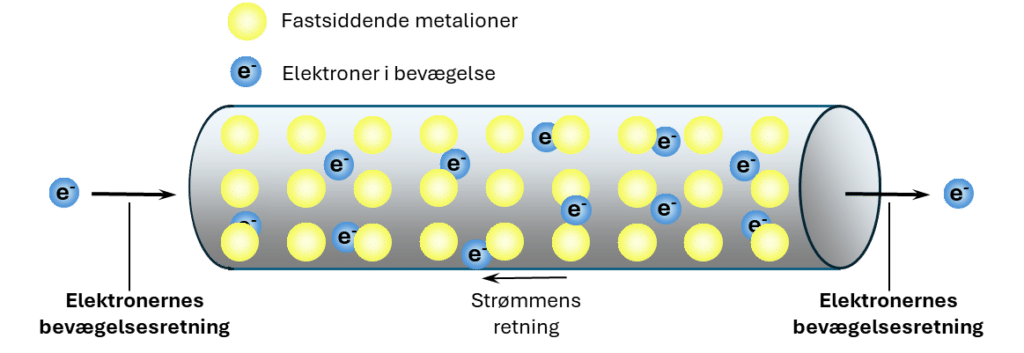
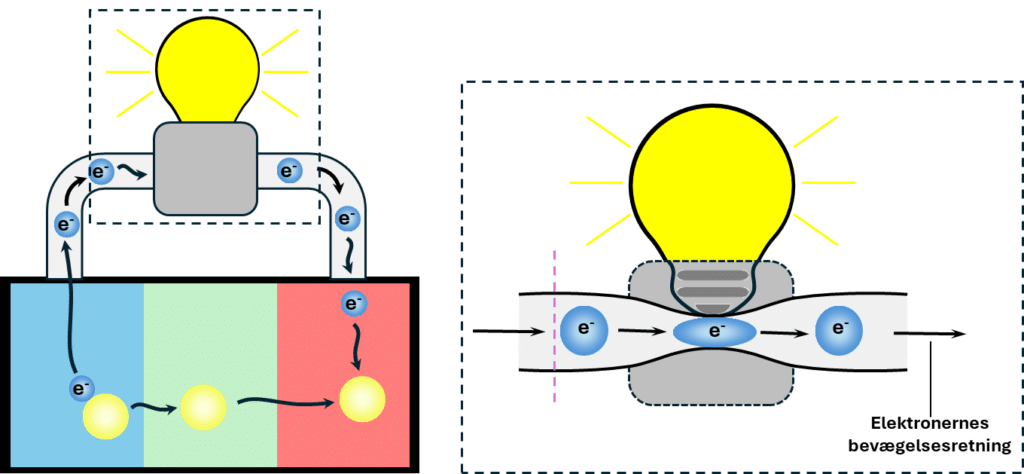
Bevægelsen af elektronerne (antal elektroner, der passerer et bestemt punkt pr. tid) kaldes for strømstyrken og har symbolet I. Strømstyrken måles i enheden A for ampere. I ledningen bevæger elektronerne sig næsten frit, men når strømmen ledes igennem fx en pære, omdannes lidt af den elektriske energi, der opstår ved elektronernes bevægelse, til fx varmeenergi. Det sker ved, at elektronerne lettere støder ind i noget, som forhindrer deres frie bevægelse. De møder altså modstand eller resistans. Modstand har symbolet R og måles i Ω, som står for ohm. Nu kender du 2 af i alt 3 variable i Ohms lov. Den sidste variable er spændingsforskellen, som kan forstås som den energi, fx et batteri skal bruge for at ”presse” elektronerne igennem ledningen med. Spændingsforskel har symbolet U og måles i enheden V for volt. Enheden for spændingsforskel er opkaldt efter netop Alessandro Volta, som du har hørt om ovenfor. Sammenhængen mellem de tre variable kaldes for Ohms lov:
𝑈=𝑅∙𝐼
Spændingsforskellen er dermed lig med modstanden ganget med strømstyrken. En visuel fortolkning kan ses i figur 8.
Du har her mødt et af mange emner i kemi, der inddrager viden fra fysik. Kemi bruger også viden fra mange andre fag som matematik, biologi, geologi osv.
Se mere
Du skal nu bygge et simpelt batteri i laboratoriet og undersøge, om du kan få en strømmen til at løbe, når det tilsluttes et voltmeter. Bagefter går vi i dybden med de kemiske redoxreaktioner i forsøget.
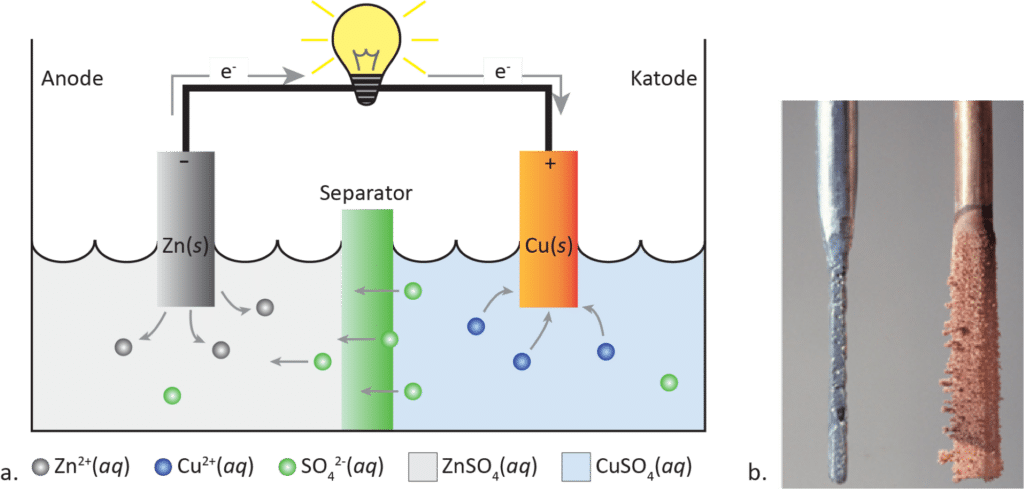
Hvis vi kigger nærmere på Alessandro Voltas første batteri, så havde han kobber- og zinkplader adskilt af pap, der var fugtet i saltvand. Zinkpladen fungerede som anode og kobberpladen som katode, mens saltvandet i det våde pap fungerede som elektrolytten. Voltas batteri var ikke særlig effektivt, men du kan bygge et batteri, der minder meget om det, og måle med et voltmeter, om du kan få strømmen til at løbe gennem det.
Forsøg 1 viser, at batteriet kan lede strøm. Elektronerne bevæger sig fra zink til kobber gennem det eksterne, elektriske kredsløb, da zink kan afgive elektroner til kobber og ikke omvendt (se figur 9a). Zinkatomer på zinkstykket bliver oxideret og afgiver elektroner til kredsløbet og bliver dermed til zinkioner, der er opløst i væsken. Dermed går zinkstykket i opløsning og bliver mindre (se figur 9b), hvilket beskrives i delreaktion (2):
Zn(s) → Zn2+(aq) + 2 e–
(2)
Samtidig modtager kobberstykket to elektroner, som straks finder sammen med en kobber(2+)ion, der er i opløsningen (se figur 9a). Ved en reduktionsreaktion danner elektronerne og kobber(2+)ionen et kobberatom, som sætter sig på kobberstykket, som dermed vokser i størrelse (se figur 9b), som vist i delreaktion (3):
Cu2+(aq) + 2 e– → Cu(s)
(3)
Den samlede redoxreaktion for oxidations- og reduktionsreaktionerne bliver:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
(4)
Man siger, at zink oxideres til zinkioner, og kobber(2+)ioner reduceres til kobberatomer. Bemærk, at partiklen, der oxideres står på reduceret form på venstre side (Zn(s) i dette tilfælde), mens det står på oxideret form på højre side (Zn2+(aq)). Det gælder modsat for partiklen, der reduceres (Cu2+(aq) på venstre side og Cu(s) på højre side).
Du får senere en forklaring på, hvorfor der står ”2+” i parentes i navnet kobber(2+)ion i teksten ovenfor, men måske kan du allerede nu gennemskue det og gætte navnet for denne kobberion: Cu+?
Se mere
Når nu man kan lave kobber, kan man så også lave sølv og guld? I gamle dage forsøgte mange folk at lave guld på forskellige måder – de blev kaldt for alkymister. En af de mere kendte historier om en alkymist handler om købmanden Brandt fra Hamborg. I sit forsøg på at fremstille guld indsamlede han urin fra sine naboer og inddampede det. Tilbage var en tyk, selvlysende masse, som han først troede var guld. Det skulle senere vise sig, at han havde opdaget grundstoffet phosphor. Læs mere her.
Når dit sølvsmykke eller dine bedsteforældres sølvtøj bliver mørkt eller helt sort, så er sølvatomer på overfladen blevet oxideret til sølv(1+)ioner.
Opskriv oxidationen af sølvatomer. Et sølvatom afgiver kun en enkelt elektron. Brug evt. reaktionsskema (1) som eksempel.
Se mere
Du skal i det følgende forsøg undersøge, om du kan få dine egne sølvsmykker eller dine bedsteforældres sølvtøj til at skinne pænt igen. Hvis ikke, er sølvet nok sølvplet, dvs det er lavet af fx messing, der er overtrukket med et tynd lag af sølv, som kan slides af.
Efter du nu har lavet oldemorforsøget, skal du i denne opgave dykke ned i de kemiske reaktioner, der sker i forbindelse med forsøget.
I fossile brændstoffer findes der små mængder svovl, der frigives som dihydrogensulfid (H2S) ved afbrænding. Dihydrogensulfid dannes også ud fra nedbrydning af dødt, organisk materiale. Gassen er giftig og lugter af rådne æg. En kemisk formel for fossilt brændstof med svovl i kunne være C7H16S.
1. Opskriv og afstem et reaktionsskema for forbrændingen af C7H16S, idet der også dannes carbondioxid og vand. Du skal huske dioxygen (O2) som reaktant.
Denne reaktion er faktisk en redoxreaktion, hvor det organiske materiale oxideres. Læs mere om organiske redoxreaktioner her.
Sølv kan reagere med dihydrogensulfidgassen, idet der dannes dihydrogen på gasform og sølv(I)sulfid.
2. Opskriv et afstemt reaktionsskema for denne reaktion.
Reaktionsskemaet beskriver, hvad der sker, når sølv bliver mørkt. Også her er der tale om en redoxreaktion.
3. Hvad er den sorte belægning på sølvet? Angiv både formel og navn.
4. Opskriv et afstemt reaktionsskema for den oxidation, der sker under reaktionen, du har skrevet som svar på spørgsmål 2.
Sølv kan renses for denne belægning ved at lave en slags elektrisk kredsløb, hvor elektroner overføres til sølvionerne i belægningen.
5. Opskriv et afstemt reaktionsskema, der viser det. Er dette en oxidation eller en reduktion?
Elektronerne kan f.eks. komme fra alufolie også kaldet sølvpapir, selvom det består af metallet aluminium.
6. Hvor mange elektroner afgiver et aluminiumatom? Her kan du med fordel anvende grundstoffets placering i det periodiske system.
7. Opskriv et afstemt reaktionsskema, der viser, hvordan aluminiumatomer afgiver elektroner og omdannes til en ion. Er dette en oxidation eller en reduktion?
8. Opskriv et afstemt reaktionsskema for den samlede redoxreaktion (elektronoverførsel) mellem sølv(I)ioner og aluminiumatomer.
Reaktionen foregår kun, hvis sølvtøjet og aluminiumsfolien rører ved hinanden, men hvis det placeres i vand med ioner (fx natrium- og chloridioner), vil reaktionen ske, uden de rører hinanden, da vandet ligesom i dit Volta-batteri fungerer som elektrolyt.
Opgave 3: Kemien i oldemorsforsøget med ekstra hjælp – download her.
Se mere
Bonusinformation: Hvis din oldemor protesterer og siger, at gammeldags sølvpudsemiddel er bedre, så kan du svare, at hver gang hun bruger det, forsvinder der lidt sølv fra smykket eller sølvbestikket. Oldemorforsøgets rensning bevarer derimod alt sølvet i smykket eller sølvbestikket.
Oldemorforsøget har vist, at man godt kan lave sølv ud fra andre metaller, så længe der er sølv(I)ioner til stede, som der er i den sorte belægning på sølvet, før det bliver ”pudset”. Sølv kan altså ikke laves ud af det blå.
Du har nu set, at et metal kan oxidere eller reducere et andet metal. Du skal nu prøve at finde frem til et system for, hvornår et metal kan oxidere eller reducere et andet metal.
Forsøget kan erstattes med opgave 4 nedenfor.
Du kan enten lave forsøg 3 eller 4.
Opgaven kan erstattes med ”Forsøg 3: Metaller i rækkefølge” ovenfor.
Oplysning 1:
Din forbedrede udgave af Voltas batteri i forsøg 1 viste, at zinkatomet oxideres og kobber(2+)ionen reduceres efter denne reaktion:
| Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s) | (5) |
Reaktionen kan ikke ske modsat af sig selv (reaktionen er altså ikke spontan)!
Oplysning 2:
Når en kobbertråd nedsænkes i en opløsning af sølvioner, dannes sølvatomer, der sætter sig som faste krystaller på kobbertråden. Væsken bliver mere og mere blå efterhånden som kobbertråden går i opløsning og danner den blå kobber(2+)ion.
Kobber afgiver 2 elektroner pr. atom, og sølv optager 1 elektron pr. atom:
| Cu(s) + Ag+(aq) → Cu2+(aq) + Ag(s) | (6a) |
Reaktionsskemaet skal afstemmes, så antallet af elektroner, der afgives, er det samme som antallet af elektroner, der optages:
| Cu(s) + 2 Ag+(aq) → Cu2+(aq) + 2 Ag(s) | (6b) |
Reaktionen kan ikke ske modsat!
Oplysning 3:
Når et zinkstykke nedsænkes i en opløsning af sølv(1+)ioner, resulterer det i sølvatomer, der sætter sig som faste krystaller på bunden. Zinkstykket går i opløsning og bliver til ioner:
| Zn(s) + 2 Ag+(aq) → Zn2+(aq) + 2 Ag(s) | (7) |
Reaktionen kan ikke ske modsat!
Nu ved du, at zink kan afgive elektroner til kobber(2+)ioner, så der dannes kobber, og kobber kan afgive elektroner til sølvioner, så der dannes sølv, og zink også kan afgive elektroner til sølvioner, så der dannes sølv. Hvilken rækkefølge kan du nu opstille disse tre metaller i, så det metal, der lettest afgiver sine elektroner, står længst til venstre, og det metal, der lettest optager sine elektroner, står længst til højre?
Se mere
Du har nu fundet ud af, at nogle metaller kan oxideres lettere end andre, og at de kan opskrives i en rækkefølge alt efter deres tilbøjelighed til at blive oxideret, så metallet, der har lettest ved at blive oxideret, står længst til venstre. Denne rækkefølge kaldes spændingsrækken. Spændingsrækken indeholder flere metaller, end du har undersøgt ovenfor (se figur 10).
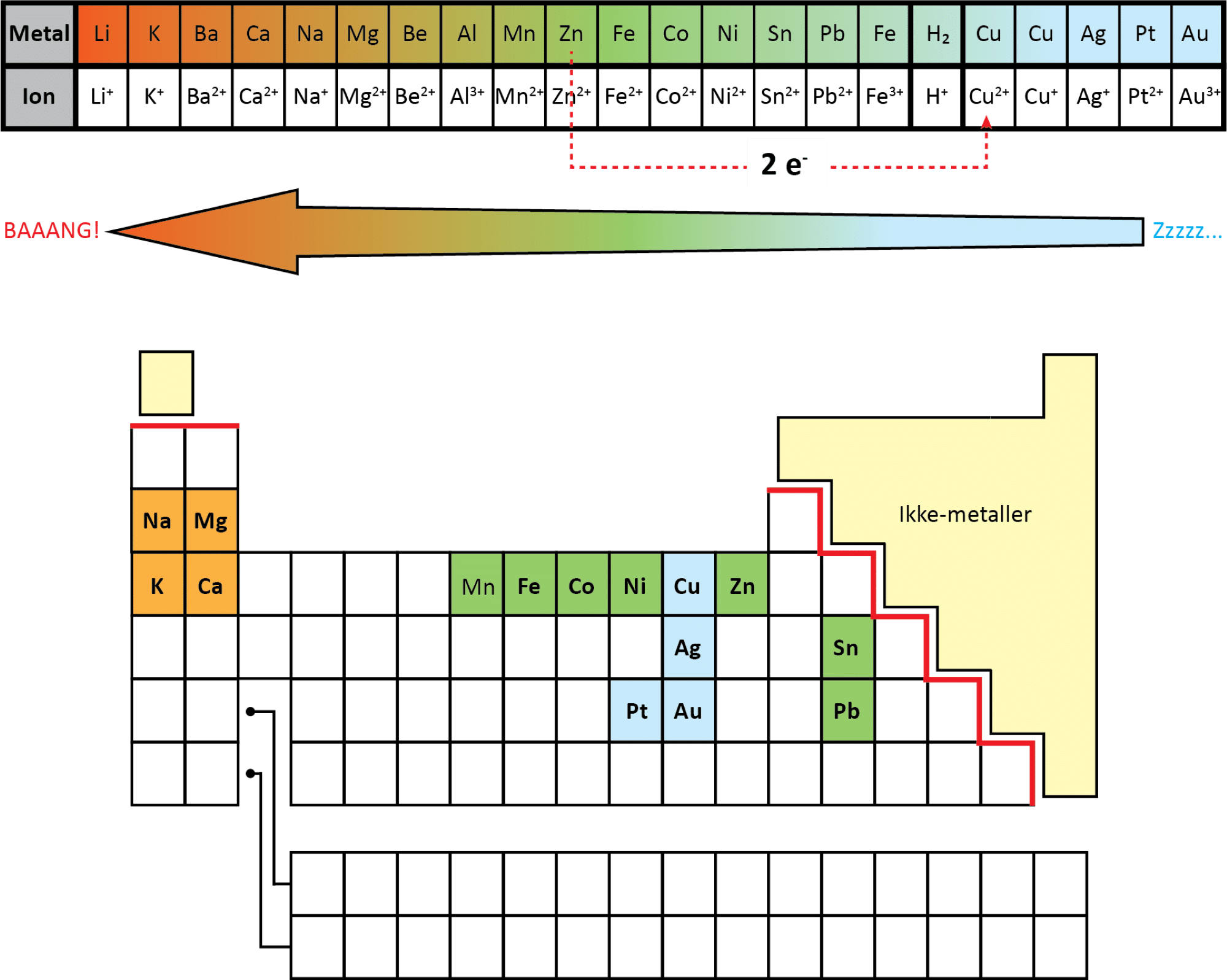
I spændingsrækken står f.eks. magnesium længere til venstre end zink. Det betyder, at magnesium er mere tilbøjelig til at afgive elektroner end zink, og magnesium kan derfor lettere oxideres end zink. Dvs. følgende redoxreaktion kan derfor godt forløbe.
Mg(s) + Zn2+(aq) → Mg2+(aq) + Zn(s)
(8)
Den modsatte reaktion kan ikke forløbe.
I denne video viser Peter Hald, sikkerhedsleder på Institut for Kemi, AU, hvordan sølv og kobber reagerer.
Ville elektronerne i oldemorforsøget ovenfor kunne komme fra guldfolie i stedet for alufolie og dermed få sølvtøjet til at skinne igen? Begrund dit ud fra dit kendskab til spændingsrækken.
Se mere
Skroget på et skib er som regel bygget af stål, som hovedsageligt består af jern med en mindre del carbon blandet i for at hærde det. I en kompleks række af kemiske redoxreaktioner ruster jernet i havvandet. Rust består af en blanding af forskellige kemiske forbindelser mellem jern, oxid og hydroxid, og en præcis kemisk formel for rust findes ikke. I opgaven antages det, at rust kun indeholder jern(2+)ionen. Skibets skrog kan ende med huller, og at sejle i et skib med huller har ingen selvfølgelig lyst til!
På figur 11 kan du se to skibsskrog, hvor det ene er godt i gang med at ruste, og det andet er ikke rustent men til gengæld er der sat nogle zinkplader på.

Se mere
Gammeldags sølvplomber i tænderne indeholdt sølv men også en række andre metaller i en såkaldt legering. En legering er en kombination af to eller flere metalliske grundstoffer. Legeringer laves oftest for at danne nye materialer med bedre egenskaber end dem, de enkelte grundstoffer har alene. Det gælder også dine sølvsmykker. Sølvplomberne indeholdt også kviksølv, kobber, indium, tin og zink.
Se mere
I spændingsrækken står også gassen dihydrogen, som er det eneste ikke-metal, der er i stand til at danne en positiv ion, H+, kaldet en hydron. Når hydroner er opløst i vand, er de bundet til vandmolekyler i ionen oxonium, H3O+, som påvirker surhedsgraden af opløsningen. Placeringen af dihydrogen i spændingsrækken viser derfor, at alle metaller længere til venstre kan reagere med syre, og dihydrogen dannes som produkt:
Mg(s) + 2 H+(aq) → Mg2+(aq) + H2(g)
(9)
I syre-basereaktioner skriver man oxonium i stedet for hydroner, da hydroner aldrig findes alene i nærheden af vand, men for at gøre redoxreaktioner mere overskuelige, skriver man det som hydroner i lige præcis disse reaktionsskemaer. Ellers ville reaktionsskemaet se således ud:
Mg(s) + 2 H3O+(aq) → Mg2+(aq) + H2(g) + 2 H2O(l)
(10)
Metallerne til højre for dihydrogen reagerer ikke med syre. I forsøg 3 (spændingsrækken) nedenfor skal du teste flere metallers reaktion med syre.
Diskutér med en anden fra dit kemihold, hvorfor det ikke er en god ide at pakke sure madvarer ind i sølvpapir.
Se mere
Mere om oxidation
Den oprindelige forståelse af en oxidation var, at et stof optog oxygen, og definitionen på en reduktion var en afgivelse af oxygen. Når et stof brænder, reagerer det altid med luftens dioxygen:
| 2 Mg(s) + O2(g) → 2 MgO(s) | (11) |
Magnesiumoxid består af ionerne Mg2+ og O2–, dvs magnesiumatomet har afgivet to elektroner:
| Mg → Mg2+ + 2 e– | (12) |
…og oxygenatomerne i dioxygen har hver optaget to elektroner:
| O2 + 4 e– → 2 O2- | (13) |
Oxygenatomerne har altså ved reaktionen fået to elektroner hver, og magnesiumatomet har afgivet to elektroner. For at elektronregnskabet går op, skal der bruges to magnesiumatomer, der hver afgiver 2 elektroner, dvs. i alt 4 elektroner afgives, hvilket stemmer med det totale antal elektroner, som de to oxygenatomer i dioxygen optager (se reaktion ovenfor).
De fleste andre metaller kan også afgive elektroner til oxygen, og de er derfor blevet oxideret. Også ikke-metaller som carbon kan oxideres efter den oprindelige definition af oxidation som oxidation ved reaktion med dioxygen:
| C(s) + O2(g) → CO2(g) | (14) |
Oxygen er et meget elektronegativt grundstof, dvs. det er meget tilbøjeligt til at optage elektroner, og det forklarer dets evne til at oxidere mange stoffer. Også andre meget elektronegative grundstoffer kan gøre det, og derfor har oxidation ikke altid noget med oxygen at gøre. Her er et eksempel:
| 2 Fe(s) + 3 Cl2(g) → 2 FeCl3(s) | (15) |
| Cu(s) + Br2(g) → CuBr2(s) | (16) |
Vi vender tilbage til sammenhængen mellem et grundstofs elektronegativitet og dets evne til at oxidere eller reducere andre materialer.
Se mere
I det næste forsøg skal du ud fra spændingsrækken prøve at forudsige, hvad du forventer af resultater, når du blander forskellige metaller og metalioner.
I dette forsøg skal du ud fra spændingsrækken forudsige, om en reaktion mellem en opløsning af en metalion og et andet, fast metal vil forløbe. Du kommer også til at arbejde med formulering af hypoteser, og forskellen på formulering af resultat- og diskussionsafsnit i en kemirapport.
Hvis du allerede har lavet forsøg 3, skal du springe dette forsøg over, da du kun enten skal lave forsøg 3 eller 4.
I forsøget ”Voltas batteri – bare bedre” benyttede du zink- og kobberplader for at få en strøm til at løbe.
Se mere
Spændingsrækken viser, om det er muligt, at en reaktion kan forløbe mellem to metaller eller en syre, men derfor er det ikke sikkert, at reaktionen rent faktisk forløber. F.eks. burde både aluminium og bly, som står til venstre for dihydrogen i spændingsrækken, reagere med syre, men det gør metallerne ikke så let, medmindre snitfladen i metallet er helt frisk. Det skyldes, at der kan dannes et beskyttende oxidlag yderst på metallet, da metallet reagerer med luftens dioxygen i en redoxreaktion. Faktisk vil aluminium som rent metal næsten altid se mat ud netop pga. oxidlaget. Reaktion 17 og 18 nedenfor er eksempler på metaller, der danner et oxidlag yderst:
2 Al(s) + 3 O2(g) → 2 Al2O3(s)
(17)
2 Pb(s) + O2(g) → 2 PbO(s)
(18)
Ud fra spændingsrækken kan man godt lave sølv ud fra en opløsning af sølvioner eller en ionforbindelse med sølv med et metal længere til venstre for sølv, og det samme gælder for guld, så man kan godt lave sølv og guld med andre metaller, men det kan ikke økonomisk betale sig.
Redoxreaktioner med bly, som vist ovenfor, har været brugt til batterier siden 1859, og rigtig mange bilbatterier i benzinbiler har været baseret på bly, som er et giftigt tungmetal. Det første genopladelige batteri, den såkaldte blyakkumulator i biler, blev fremstillet af fysikeren Gaston Planté.
3. Hvad er forskellen på et traditionelt og et genopladeligt batteri?
Nu hvor den grundlæggende redoxkemi er introduceret, kan vi undersøge forskellen på et traditionelt og et genopladeligt batteri. Genopladelige batterier er mere miljøvenlige, fordi de kan bruges flere gange.
I det traditionelle alkaliske brunstensbatteri (se figur 12) findes som i alle andre batterier en negativ pol (anoden), en positiv pol (katoden), og elektrolytten, der sørger for, at elektronerne ikke kan vandre inden i batteriet fra anoden til katoden, men er nødt til at gå gennem ledningen, der løber uden for batteriet.

Elektrolytten er en basisk væske, hvor hydroxid er opløst i, dvs. tilstandsformen for ionen er OH–(elektrolyt). Flere reaktionsskemaer i batterier nedenfor får også denne tilstandsform. Anoden består af zinkpulver (Zn), der ligger i en gelé, så det ikke flytter sig rundt, og følgende oxidationsreaktion sker:
Zn(s) + 2 OH–(elektrolyt) → ZnO(s) + H2O(l) + 2 e–
(19)
I katoden, der består af mangan(4+)oxid (MnO2), også kaldet brunsten, sker følgende reduktion:
2 MnO2(s) + H2O(l) + 2 e– → Mn2O3(s) + 2 OH–(elektrolyt)
(20)
Den samlede reaktion bliver derfor:
Zn(s) + 2 MnO2(s) → ZnO(s) + Mn2O3(s)
(21)
Der dannes ikke vand i batteriet, da de to delreaktioner (19 og 20) sker på samme tid.
Hvilket metal i reaktionen ovenfor afgiver elektroner til det andet metal? Stemmer det overens med de to metallers placering i forhold til hinanden i spændingsrækken?
Se mere
Udfordringerne ved det alkaliske brunstensbatteri er, at redoxreaktionen ikke kan løbe den modsatte vej, og det kan derfor ikke genoplades. Denne type engangsbatterier kaldes for primære batterier. Forsøger man alligevel at genoplade batterierne, kan der dannes et overtryk af dihydrogen, som kan gøre, at batteriet går i stykker, og den basiske (alkaliske) elektrolyt, kaliumhydroxid, løber ud. Dette kan også ske, når batteriet udsættes for fugt, høje temperaturer eller bare bliver gammelt. Ofte vil man kunne se et salt danne sig udenpå batteriet (se figur 12.b), hvor kaliumhydroxiden har reageret med luftens carbondioxid og dannet kaliumcarbonat (se reaktionsskema nedenfor). Kaliumcarbonat kan ætse videre på et andet metal i det apparat, batteriet sidder i, og dermed risikerer man at apparatet går i stykker. Desuden skal man undgå at få det på sig selv.
2 KOH(aq) + CO2(g) → K2CO3(s) + H2O(l)
(22)
I genopladelige batterier også kaldet sekundære batterier kan man få redoxreaktionen til at gå den modsatte vej, når man tilslutter en ekstern strømkilde. Det klassiske eksempel på et genopladeligt batteri er blyakkumulatoren, der findes i bl.a. startmotoren i benzin- eller dieseldrevne biler. Batteriet indeholder 30% svovlsyre og tungmetallet bly i form af metallisk bly (Pb) og bly(4+)oxid (PbO2). Bly er meget giftigt, og svovlsyren er en stærk syre og meget ætsende, hvis det pludselig bliver utæt. Pga. indholdet er det også problematisk, når det skal bortskaffes. Når batteriet bruges, sker følgende oxidation ved anoden, som består af en ren blyplade nedsænket i svovlsyre:
Pb(s) + SO42-(elektrolyt) → PbSO4(s) + 2 e–
(23)
Og ved katoden, som også består af en blyplade dog med en overflade af bly(4+)oxid, sker reduktionen:
PbO2(s) + 4 H+(elektrolyt) + SO42-(elektrolyt) + 2 e– → PbSO4(s) + 2 H2O(l)
(24)
Denne redoxreaktion er ikke lige til at gennemskue uden at bygge lidt mere teori ovenpå, hvor vi undersøger, hvordan vi kan holde styr på antallet af elektroner, der overføres i redoxreaktioner. Det kommer du til at møde senere i materialet.
Brug de to delreaktioner (23 og 24) til at finde frem til den samlede reaktion ved afladning/brug af bilbatteriet.
Se mere
Hvis først blybatteriet i startmotoren var afladet, hvilket kunne ske, når der var meget koldt, kunne de typisk oplades igen udefra. Dette kunne gøres i nogle år, hvorefter man var nødt til at skifte batteriet.
Uanset hvad, er blybatterier problematiske pga. indholdet af bly. Heldigvis findes der andre typer af genopladelige batterier, der ikke indeholder det giftige bly. Lithiumionbatteriet er et eksempel på et blyfrit batteri. Det er det mest anvendte batteri i dag, da det har mange fordele, og det forventes en stor stigning i forbrug af lithiumionbatterier til elbiler og til de store batteriparker (se figur 13), som bygges bl.a. på Bornholm. Læs mere her

I lithiumionbatterier dannes der strøm på baggrund af forskellen i koncentration af lithiumioner mellem katoden og anoden. Begge poler består af elektrisk ledende materiale, der er i stand til at oplagre lithiumioner i deres krystalstruktur.
Anoden er lavet af grafit, som kun består af carbonatomer. Grafit er fx det, der er i blyanter. Hver gang, du tegner en streg med en blyant, gnider du nogle få lag af grafitten, som så sidder på papiret. Hvert af disse lag er kun et atom i tykkelse, og mellem disse er der plads til lithiumatomer (se figur 14).
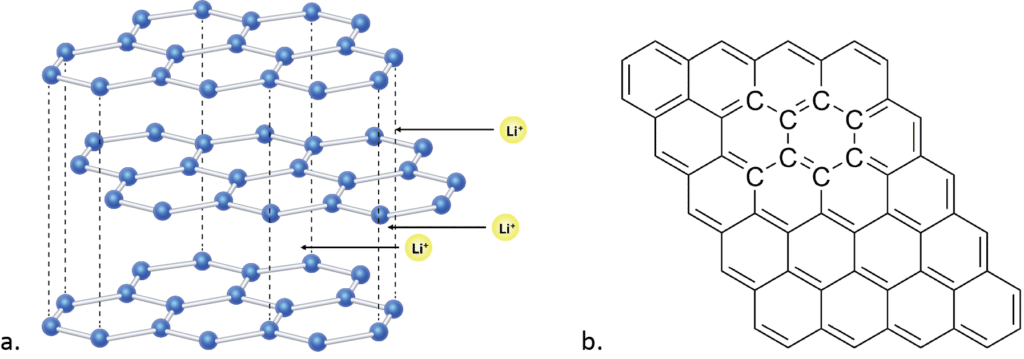
Ved anoden sker følgende reaktion:
LiC6(s) → C6(s) + Li+(elektrolyt) + e–
(25)
Er der tale om en oxidation eller reduktion af lithiumatomet?
Se mere
Katoden kan bestå af lithium-X-oxid (LiXO2), hvor X ligesom i matematik er en ubekendt og kan her fx være grundstofferne cobalt, nikkel, aluminium eller mangan. Der har været stor brug af lithiumcobaltoxid, hvilket forklarer historien i starten af kapitlet. Den kan også bestå af lithium-jern-phosphat (LiFePO4), hvilket sker mere og mere for at undgå cobalt. Ligesom anoden er også katoden opbygget i lag bestående fx af cobaltoxid og med lithiumioner mellem lagene (se figur 15).
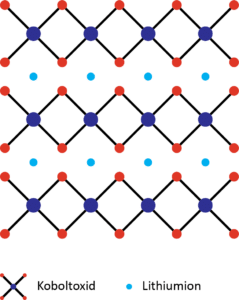
Ved katoden vist i figur 15 sker følgende reaktion:
CoO2(s) + Li+(aq) + e– → LiCoO2(s)
(26)
Er der umiddelbart tale om en oxidation eller en reduktion af lithiumionen? Faktisk er det ikke lithiumionen, der modtager elektronen, men cobalt, som ændrer sig fra Co4+ til Co3+.
Se mere
Inde i selve batteriet er anoden og katoden lange, tynde ark, som rulles sammen adskilt af et separatorlag, hvor kun lithiumioner kan passere men ikke elektroner. Hvis ikke separatorlaget var der, ville batteriet kortslutte, da elektronerne i stedet ville passere direkte fra anoden til katoden og ikke gennem det eksterne kredsløb (se figur 16).
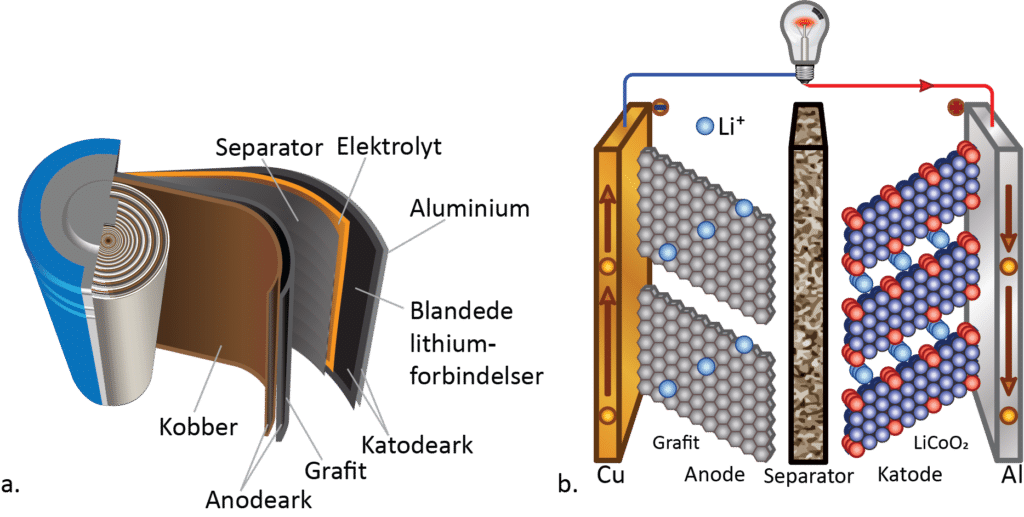
Når et lithiumionbatteri er i brug og dermed aflader, bevæger lithiumioner sig fra anoden til katoden, mens elektronerne passerer gennem det eksterne kredsløb og fx kan få en pære til at lyse eller el-bilen til at køre. Omvendt når batteriet er fladt og skal oplades, tilsluttes en ekstern strømkilde, der tvinger lithiumionerne tilbage til anoden, hvor de modtager en elektron fra det eksterne kredsløb.
din krop har sit eget genopladelige batteri, der bruges og aflades? Når du spiser, bliver energien i de kemiske bindinger i maden overført til kemiske bindinger i kulhydratet glukose. Forsimplet kan man sige, at når der er overskud af glukose, samles glukosemolekylerne i kæmpestore molekyler kaldet glykogen, et slags batterimolekyle, som kan oplagres. Du bruger langsomt dette, og når du er sulten, skal batteriet genoplades ved at du spiser et nyt måltid.
Rent energimæssigt/miljømæssigt er genopladelige batterier at foretrække, da de ikke smides ud efter brug, men er de nu så gode for miljøet, som vi går rundt og tænker?
4. Hvad er problemet med eksisterende batterier?
Vi er alle ved at omstille os til at bruge genopladelige batterier, og de fleste af disse er baseret på lithiumionteknologien forklaret ovenfor. I 2019 blev John B. Goodenough, M. Stanley Whittingham og Akira Yoshino tildelt Nobelprisen i kemi for udviklingen af denne teknologi, som er resulteret i genopladelige, letvægtsbatterier, som bruges over alt. Læs fx om det nye kæmpebatteri på Borhholm.
Dorthe Ravnsbæk har du mødt i starten af dette forløb, og hun skriver om lithiumionbatterierne:
‘Det kommercielle Li-ion-batteri fejrede for nylig sin 30-års fødselsdag og har allerede sat et stort aftryk på vores samfund. I dag giver teknologien liv til stort set al elektronik, vi omgiver os med, og har dertil fundet vej ind i elbiler. Genopladelige batterier står nu overfor den næste landvinding: Lagring af vedvarende energi. De nye anvendelser og det stigende forbrug af Li-ion-batterier sætter store krav til ydeevne, levetid, pris og bæredygtighed.’
Lithiumionbatterier kan udover grundstoffet lithium indeholde andre grundstoffer, som af miljømæssige, etiske og politiske årsager kan være svære at udvinde tilstrækkeligt af i fremtiden. Desuden er forekomsten af nogle af grundstofferne i disse batterier relativt begrænset. Og selvom genopladelige batterier kan bruges mange gange, så bliver de langsomt dårligere og dårligere og skal til sidst kasseres. Hvordan skaffer man sig af med brugte batterier? Her vil du nok tænke, at dem kan man putte i nogle genbrugskasser eller aflevere på en genbrugsstation, men hvordan kommer de videre derfra?
Cobalt er et grundstof, der helt siden bronzealderen har været brugt til at farve glas. Farven cobaltblå har sit navn fra grundstoffet. Det udvindes primært fra miner i Den Demokratiske Republik Congo i det centrale Afrika. Der er mange udenlandske mineselskaber, der har miner og mange lokalt ansatte i landet, men for mange folk kan det godt betale sig at udvinde mineralet ulovligt, da stenene, der indeholder cobaltmineraler, altid kan sælges på det sorte marked. Cobaltmineraler er kemiske forbindelser med cobalt – fx cobaltit, der er en forbindelse af grundstofferne cobalt, arsen og svovl (se figur 17). Mange af minearbejderne bliver syge af minearbejdet.
I følgende nyhedsindslag fra Sky News kan man tydeligt se problemerne ved cobaltudvinding.
Heller ikke lithium udgraves under hensyntagen til minearbejdernes arbejdsforhold eller det omkringliggende miljø. Et område på tværs af Bolivia, Chile og Argentina i Sydamerika har en høj forekomst af metallet, der også kaldes for ”letvægtsguld”, da det har en høj værdi, men samtidig er det et let grundstof, der ikke vejer meget. I dette filmklip fra Insider News kan man blive klogere på udgravning af lithium.
Læs mere i temaet ‘Grundstoffer og bæredygtighed‘.
Selvom genopladelige lithiumionbatterier i den nuværende form er bedre end ikke-genopladelige batterier, kan de nok næppe kaldes for grønne batterier, når både lithium og cobalt er problematiske grundstoffer at udvinde, og ingen af dem findes i store mængder på jorden. Du skal nedenfor undersøge hvilke grundstoffer, der kan erstatte de problematiske grundstoffer, der er omtalt ovenfor. Du skal arbejde både teoretisk og eksperimentelt og slutte af med et brev til Dorthe, som du har mødt i starten af Fremtidens batterier, hvor du argumenterer for de grundstoffer, du er kommet frem til, at hun og andre batteriforskere bør undersøge nærmere.
5. Hvilke grundstoffer skal vi bygge fremtidens batterier af?
Nu skal du undersøge og regne på forskellige parametre og på den måde komme frem til dit eget bud på, hvilke grundstoffer du mener, vi skal bygge fremtidens batterier af. Du skal ende med at skrive en anbefaling til professor Dorthe Ravnsbæk, som du mødte tidligere i materialet.
1. Færdiggør nedenstående delreaktioner og bestem, hvilken af dem vil give den højeste strøm (antal elektroner, der passerer et bestemt punkt pr. tid), hvis grundstoffet kunne bruges i et batteri. Sæt reaktionsskemaerne ind i skemaet på næste side.
a. Li(s) → Li+(aq) + e–
b. Mg(s) →
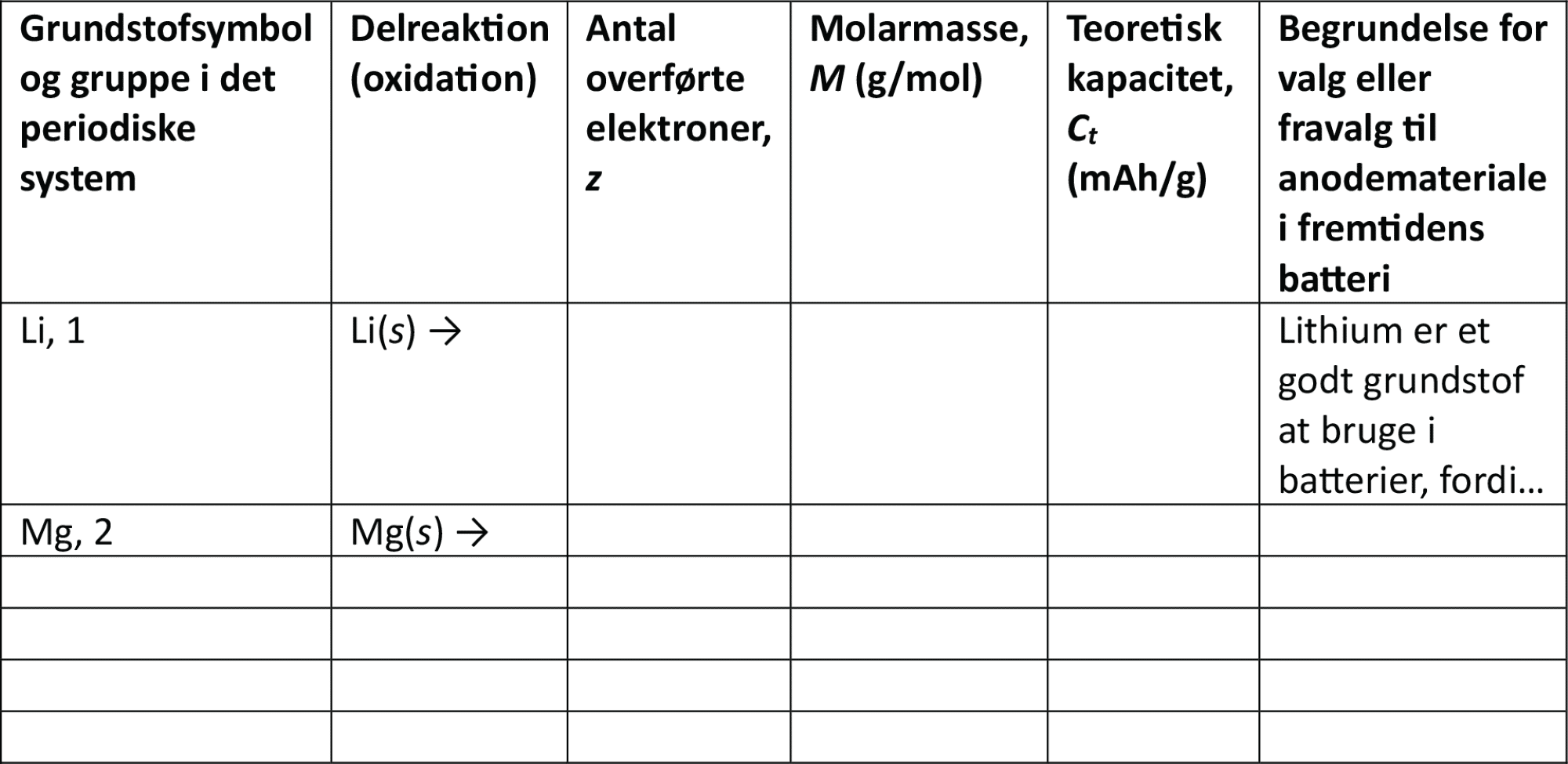
Antallet af overførte elektroner mellem anoden og katoden gennem det eksterne, elektriske kredsløb har betydning for, hvor stor en kapacitet et batteri har, dvs. hvor længe det holder til en bestemt belastning. Man kan regne både på anodens og katodens teoretiske kapacitet, hvis man ved, hvad anodens og katodens materiale består af. Her fokuserer vi på anodens materiale. Jo flere elektroner, der kan afgives pr. formelenhed, jo højere strømstyrke. Den teoretiske kapacitet, Ct, er givet ved formlen
z er antallet af overførte elektroner, F er Faradays konstant (96485,3 C/mol) og M er elektrodematerialets molarmasse. 3,6 er en konstant, som i første omgang ikke er vigtig at gennemskue. Den teoretiske kapacitet har enheden mAh/g, dvs milliamperetimer pr. gram. I det følgende kan du regne uden enheder og nøjes med at forholde dig til størrelsen af værdien af den teoretiske kapacitet, som altså bør være så høj som mulig.
2. Med udgangspunkt i de færdiggjorte delreaktioner fra opgave 1a og 1b skal du beregne lithiums og magnesiums teoretiske kapaciteter. Sæt værdierne ind i skemaet nedenfor.
3. Beregn den teoretiske kapacitet for 4 andre grundstoffer rundt omkring i det periodiske system, dvs. grundstoffer langt oppe, langt nede, til højre, til venstre og i midten.
a. Hvilken betydning har molarmassen for den teoretiske kapacitet?
b. Hvilken betydning har antallet af overførte elektroner for den teoretiske kapacitet?
c. Er der et system for hvilke grundstoffer, der giver en høj teoretisk kapacitet i forhold til deres placering i det periodiske system?
d. Skriv i tabellen nedenfor 3-4 grundstoffer, som du ud fra dine beregninger vil anbefale Dorthe at overveje i stedet for lithium i batterier. Du skal kunne argumentere for dit valg. Brug dine beregninger af de teoretiske kapaciteter samt svarene fra opgave 3a og 3b i din argumentation.
Den næste opgave er valgfri, da den er temmelig svær. Aftal med din lærer, om du skal prøve at løse den.
4. Forsøg at få enhederne i beregningerne ovenfor til at give mening. Find også ud af hvor konstanten, 3,6, kommer fra. Den teoretiske kapacitet, Ct, har enheden 𝐶/g, dvs coulomb pr gram. 1 C svarer til 1 As, dvs 1 ampere i løbet af 1 sekund. Vis, at ligningen nedenfor er rigtig, dvs. at enheden C/g svarer til 1/3,6mAh/g.
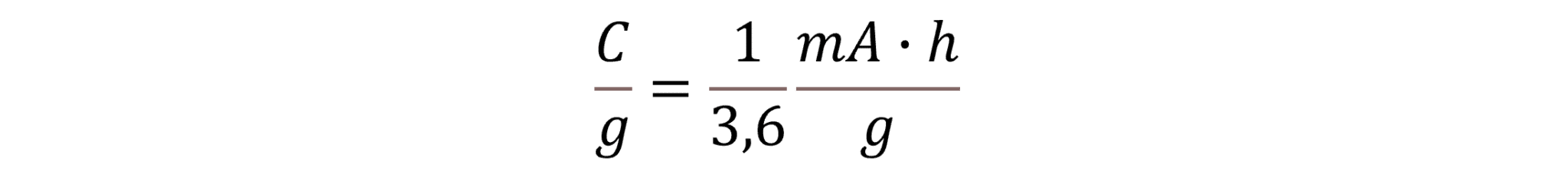
Nogle grundstoffer kan med det samme udelukkes som mulige grundstoffer i fremtidens batterier fx pga. de er giftige.
5. Udvælg 4 af dine 6 forslag til grundstoffer i fremtidens batterier og diskuter dem med din gruppe. Tag udgangspunkt i figur 18 nedenfor (du skal klikke den frem), og overvej, om du vil beholde dine forslag eller ændre dem.
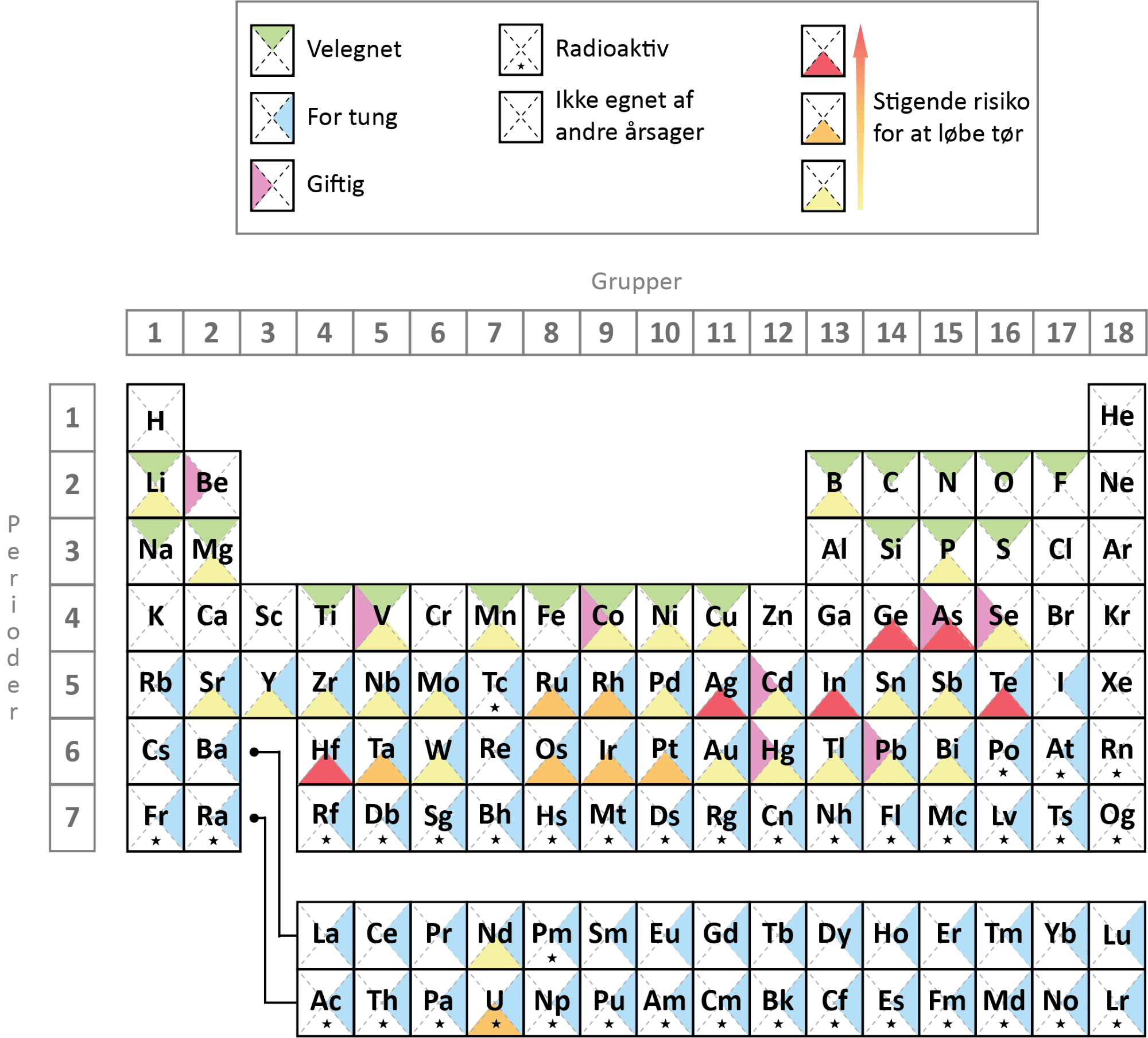
6. Skriv en kort anbefaling til Dorthe:
”Kære Dorthe,
Jeg har nu forsøgt at beregne mig frem til nye grundstoffer, der kan bruges i fremtidens batterier. Baseret på beregninger af den teoretiske kapacitet giver det mening, at du bør teste …, … Men da … er giftigt/sjældent/dyrt (vælg selv eller find alternative formuleringer)… ”
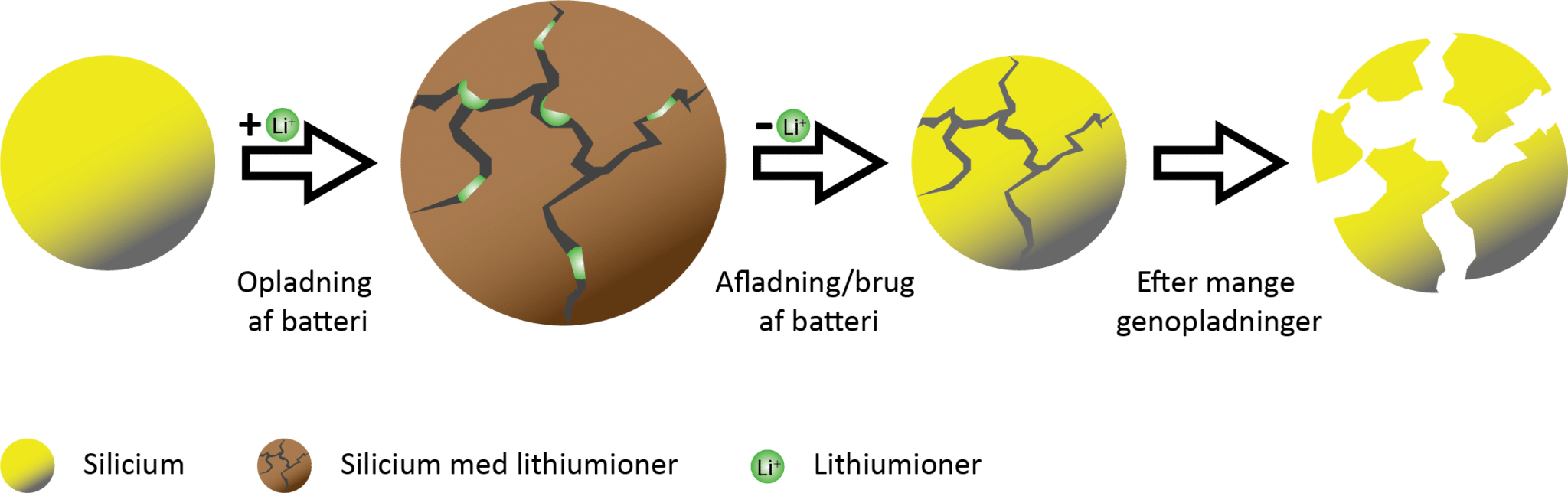
Ofte består anoden af grafit (se figur 13), hvor lithiumioner er sat ind i grafits krystalstruktur. Der kan desværre ikke pakkes mange lithiumioner ind i grafit. Der er kun plads til en lithiumion pr. 6 carbonatomer. Hvis der var plads til flere lithiumatomer, ville batteriet kunne levere mere strøm i længere tid. Forskere har været i gang med at undersøge, om silicium, som står i samme gruppe i det periodiske system som carbon og dermed har mange af de samme kemiske egenskaber som carbon, kan bruges i stedet for. Forskerne har fundet frem til, at der i anoden kan blive plads til 5 lithiumioner pr. siliciumatom, dvs. 30 gange flere lithiumioner end i grafit.
Du skal nu eksperimentelt undersøge, hvad der ville ske inde i et batteri, hvis man skiftede til silicium i anoden. Forsøget er et principforsøg, hvor du undersøger et materiale (lightersten), der opfører sig på samme måde, som silicium ville gøre. Der er ikke tale om silicium, som er et overgangsmetal, men derimod en legering af metaller. Lighterstenen, du undersøger, har derfor ikke noget at gøre med batterier i virkeligheden.
Forsøg 5: Lightersten
Lad os kigge nærmere på, hvad lighterstenen består af og hvilke kemiske reaktioner, der faktisk skete, da du varmede på den.
1. Moderne lightersten indeholder jern, lidt magnesium og de fire første lanthanider. Find ud af, hvor lanthaniderne er i det periodiske system og noter både grundstofnavn og symbol for de fire første lanthanider.
For at simplificere det lidt, antager vi, at lightersten kun består af jern (30%) og cerium (70%), som de oprindelige lightersten gjorde. Ved opvarmning reagerer både jern og cerium med luftens dioxygen i hver deres redoxreaktioner. Jern kan oxideres både til jern(2+)- og jern(3+)ioner, og cerium kan oxideres både til cerium(3+)- og cerium(4+)ioner.
2. Opskriv de 4 mulige redoxreaktioner, der sker mellem luftens dioxygen og henholdsvis jernatomer og ceriumatomer. Du kan overveje at skrive de to delreaktioner først for oxidationen og reduktionen og så samle de to reaktioner i en totalreaktion til sidst. Husk at afstemme reaktionerne, så der afgives lige mange elektroner, som der optages. Du får lidt hjælp til den første reaktion, hvor de to delreaktioner er skrevet først og bagefter totalreaktionen, som dog ikke er afstemt:
a. Fe(s) → Fe2+ + 2 e–
O2(g) → 2 O2- + 4 e–
Fe(s) + O2(g) → FeO(s) (ikke afstemt)
b. Fe(s) +
c. Ce(s) +
d. Ce(s) +
3. Brug den afvejede masse af din lightersten i starten af forsøget til at finde ud af massen og stofmængden af jern og cerium.
a. Beregn din lighterstens masse af jern i gram – m(Fe).
b. Find molarmassen for jern – M(Fe) – og beregn herefter stofmængden af jern i mol – n(Fe). Hvis du er i tvivl om, hvilken formel du kan bruge, skal du tænke på en, hvor der både indgår molarmasse og masse.
c. Beregn din lighterstens masse af cerium i gram – m(Ce).
d. Find molarmassen for cerium – M(Ce) – og beregn herefter stofmængden af cerium i mol – n(Ce).
I forsøget fandt du måske frem til, at massen af din lightersten blev større i forsøget. Det er lidt usædvanligt, at noget bliver tungere, når det varmes op. Du ved nok, at hvis du tænder et bål, så forsvinder brændet efterhånden, og massen af kulstøvet bagefter er meget mindre end det, brændet vejede. Det er, fordi en del af brændet forsvinder som gas blandt andet som carbondioxid og vanddamp. I dette forsøg forsvandt der ikke noget af massen som gas. Derfor kunne man godt tænke, at massen ville være den samme før og efter opvarmning.
4. Diskutér med din forsøgsmakker, hvorfor massen er steget. Du skal bruge dine reaktionsskemaer i opgave 2 og se på, hvilke tilstandsformer stofferne har. Hvad er det, du har vejet på vægten?
5. Brug forskellen i masse af lighterstenen fra før og efter forsøget (den har du beregnet under punkt 10a i forsøget) til at beregne, hvor stor en stofmængde af oxygen, der nu er bundet i lighterstenen. Dette svarer til det faktiske forbrug af oxygenatomer i dit forsøg, og det kalder vi i de næste beregninger for n(O)total.
Hvis du vil undersøge, om al cerium og jern er blevet oxideret i din lightersten, er du nødt til at lave en antagelse først: Alle jernatomer er oxideret til jern(3+)ioner i Fe2O3 og alle ceriumatomer er oxideret til cerium(4+)ioner i CeO2. Antagelsen burde være rimelig, idet der er meget ilt til stede i atmosfærisk luft (ca. 21%). Dvs. du kan se bort fra dannelsen af FeO og Ce2O3.
6. Beregn det forventede forbrug af oxygen.
a. Beregn stofmængden af oxygenatomer i Fe2O3. Du kender stofmængden af jernatomer fra opgave 3.b.
b. Beregn stofmængden af oxygenatomer i CeO2. Du kender stofmængden af ceriumatomer fra opgave 3.d
c. Beregn det forventede forbrug af oxygen i mol ved at lægge stofmængderne beregnet i 6.a. og 6.b. sammen.
7. Er det faktiske forbrug og det forventede forbrug af oxygen det samme?
a. Hvorfor/hvorfor ikke?
b. Du kan prøve at undersøge, om du også kan forklare en eventuel forskel i forbrug, ud fra forudsætningen, at der er 30% jern og 70% cerium i lighterstenen. Det kan du gøre ved at gennemføre beregningerne under punkt 3 og 6 i igen og antage der fx er 20% jern og 80% cerium. Passer resultaterne bedre nu?
Grunden til at din lightersten er vokset i størrelse er derfor, at den ved redoxreaktioner har optaget mange oxygenatomer fra luftens dioxygen. Det samme gælder, hvis silicium blev brugt i anoden. Fordi der er plads til så mange lithiumioner i siliciumanoden, ville den udvide sig med helt op til 300%, når den oplades og fyldes med lithiumioner. Når batteriet efterfølgende bruges og dermed aflades, så skrumper anoden igen. Under den store udvidelse og sammentrækning, går anoden i stykker. Forskere som Dorthe Ravnsbæk har undersøgt anoden nærmere og fundet ud af, at revnerne og sprækkerne fra den markante udvidelse stadig er til stede, efter den skrumper (se figur 19).
Se mere
Som du har opdaget i opgaven ovenfor, er det ikke helt enkelt at finde nye grundstoffer, der er lige så effektive og miljøvenlige som dem, vi bruger i dag. Mange kemikere verden over arbejder i et kapløb med tiden for at finde brugbare, langsigtede og bæredygtige løsninger, inden vi løber tør for mineraler til de typer batterier, vi bruger i vores hverdag i dag.
Du kan her se et dansk foredrag, hvor du kan høre om udfordringerne ved eksisterende batterier, nuværende dansk forskning i fremtidens batterier, og få svar på, om vi løber tør for batterier:

Link: ‘Løber vi tør for batterier?’ af professor Dorthe Ravnsbæk.
6. Forlæng levetiden for batteriet i din mobil
I hverdagen er mange afhængige af deres mobiltelefon, og måske er du en af dem. Det vil sikkert være rart for dig, at du kan forlænge levetiden for batteriet i din mobil, og det kan du gøre på flere måder. Det bedste er, hvis batteriet er mellem 20% og 80% opladet. Her følger et par tips til dig: