Glæd dig til dette nye tema er klar! Materialet er under udarbejdelse og lægges løbende ud i løbet af efteråret, når det er klart.
I uge 43 er der lagt nyt og spændende materiale ud om gasserne i atmosfæren.
1 Er der kemi i luften?
Ja, for alt er kemi! Men vi kender ikke al kemi – langt fra! Og al den kemi, vi kender, forstår vi ikke det hele af! Så der findes stadig en masse kemiske gåder, som vi som mennesker endnu ikke har løst. Måske bliver du en af dem, der hjælper med at løse nogle af de kemiske gåder. I dette tema møder du en af gåderne. Og du møder nogle forskere, der forsøger at løse dele af den. Prøv at kigge op! Atmosfæren er en stor samling af molekyler og partikler, som reagerer med hinanden og sollyset. Vi ved stadig meget lidt om disse kemiske reaktioner. Men ved at blive klogere på den grundlæggende atmosfærekemi kan vi bedre forstå, hvordan menneskers aktiviteter påvirker atmosfæren og måske på sigt forudsige og mindske de kemiske ændringer, der påvirker klimaet og luftkvaliteten.
2 Atmosfærens kemiske sammensætning
I figur 1 kan du se et udvalg af, hvilke gasser der findes i atmosfæren, og i hvilke koncentrationer.
Nogle af gasserne er reagerer nærmest ikke eller slet ikke pga. deres stabile elektronstruktur, andre reagerer lettere. Nogle af gasserne har flere roller afhængig af de omgivelser, de befinder sig i. Nedenfor kan du læse mere om udvalgte gasser i atmosfæren, hvor du blandt andet lærer om deres opbygning og elektronstruktur. Her vil du også møde nogle drivgasser, som ikke er med i figur 1.
Navn:
Dinitrogen er navnet, du bruger i kemi, for det siger noget om molekylets opbygning. Molekylet kaldes i daglig tale også for kvælstof, da man fandt ud af, at dyr blev kvalt, hvis de opholdt sig i en beholder uden dioxygen men med et stort indhold af dinitrogen.
Bindingstyper:
Elektronparbindinger, også kaldet kovalente bindinger, holder atomerne sammen.
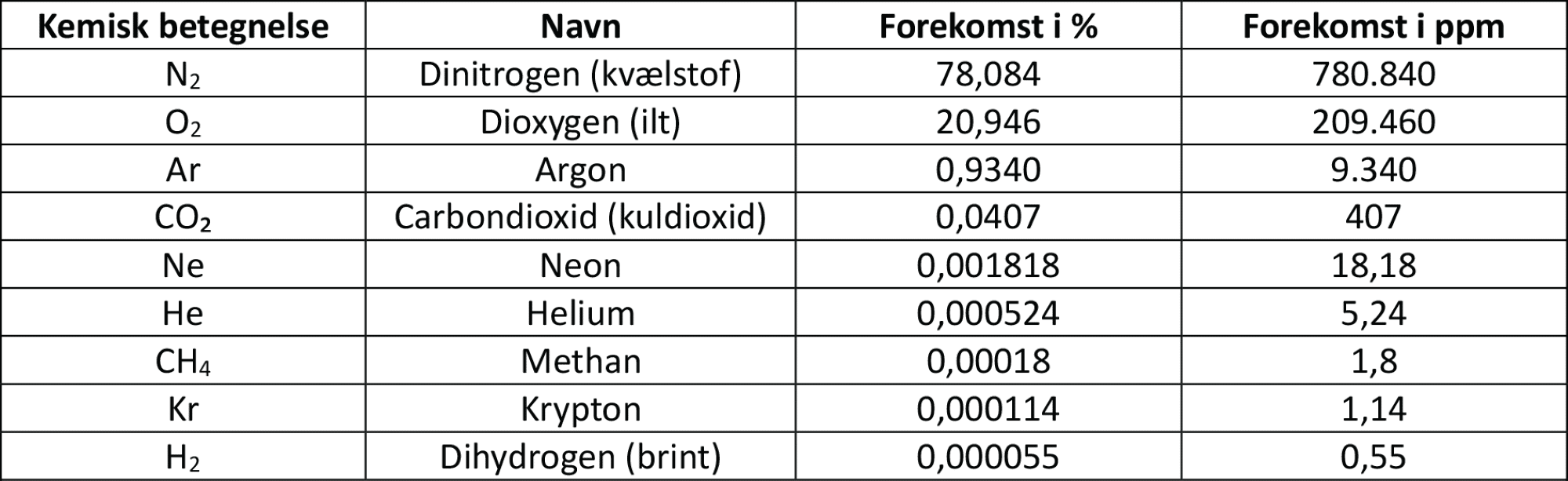
De to nitrogenatomer er bundet sammen med en trippelbinding. I figur 2 ses det i elektronprikformlen, at hvert nitrogenatom deler 6 elektroner med det andet nitrogenatom, og da der netop skal to elektroner til for at danne en binding, svarer det til en trippelbinding. Dermed opfyldes oktetreglen for begge atomer i molekylet.
Opbygning:
Dinitrogen er et diatomigt molekyle og er derfor lineært. Molekylet er upolært, da atomerne er ens og derfor har samme elektronegativitet. Dermed bliver forskellen i elektronegativitet nøjagtigt 0:
EN(N) = 3,0
ΔEN = 0,0
Fysiske og kemiske egenskaber:
I figur 3 ses forskellige fysiske egenskaber for dinitrogen. Da molekylet er upolært, opløses der ikke meget af gassen i vand ved stuetemperatur. Jo højere temperatur vandet har, jo mindre dinitrogen kan der opløses deri.

Elektronstrukturen for dinitrogen er meget stabil, og derfor er molekylet ikke særlig reaktivt.
Fun facts:
Flydende nitrogen (som selvfølgelig hedder dinitrogen i kemitimerne i gymnasiet) fascinerer, fordi det kombinerer ekstrem kulde med spektakulære virkninger og praktiske anvendelser. Når det udsættes for luft eller varme, skabes dramatisk ’røg’, der er en synlig påmindelse om fysisk og kemisk vekselvirkning. Samtidig anvendes flydende nitrogen i gastronomi for at skabe nye teksturer og smagsoplevelser, og på hospitaler, hvor vævsprøver fryses ned og kan opbevares i meget lang tid. Her kan du læse og se et par eksempler på nogle sjove anvendelser af flydende nitrogen:
1. Ekstremt koldt
Flydende nitrogen har en temperatur på ca. –196 °C. Det er koldt nok til at fryse blomster sprøde som glas på få sekunder. Og hvis du putter en oppustet ballon ned i den flydende nitrogen, klapper den helt sammen, fordi luften indeni bliver så kold, at den fylder meget mindre. Når du så tager ballonen op igen, puster den sig selv op, efterhånden som den bliver varmere. Dette sker, fordi volumen af en gas er omvendt proportional med temperaturen. Du kan søge på YouTube og finde sjove film af dette.
2. ’Magisk’ damp
Når man hælder flydende nitrogen ud, ser det ud som om der kommer røg. Men det er faktisk ikke dinitrogen men vanddamp fra luften, der kondenserer i kulden. Du kan her se Peter Hald, sikkerhedsleder på Institut for Kemi, AU, hælde flydende nitrogen op i en beholder, hvor vanddampen er tydelig. Endnu mere tydeligt bliver det, når han hælder kogende vand ned til den flydende nitrogen.
3. Biologi og medicin
Flydende nitrogen bruges til at opbevare biologiske prøver meget koldt, fx sædceller, ægceller og væv, fordi den lave temperatur stopper alle biologiske processer. Måske har du som i figur 4 også prøvet at få fjernet en fodvorte hos lægen, hvor de har brugt flydende nitrogen.

4. Gas fylder mere end væske
Hvis flydende nitrogen opbevares i en lukket beholder, kan trykket stige voldsomt, fordi væsken fordamper hurtigt, og det kan ende i en eksplosion. Derfor bruges specielle beholdere. Her kan du se Peter Hald, som viser, hvad der sker, når flydende nitrogen bliver til gas.
Du har fået forskellige oplysninger om dinitrogen ovenfor. Nu skal du sammen med en makker prøve at se, hvor meget I til sammen kan huske og har forstået om molekylet. I må ikke kigge ovenfor.
Se mere
Navn:
Dioxygen er navnet, du bruger i kemi i gymnasiet, da navnet siger noget om, hvilke atomer molekylet er opbygget af. Molekylet kaldes i daglig tale også for ilt, fordi det nærer ild.
Bindingstyper:
Elektronparbindinger holder atomerne sammen.
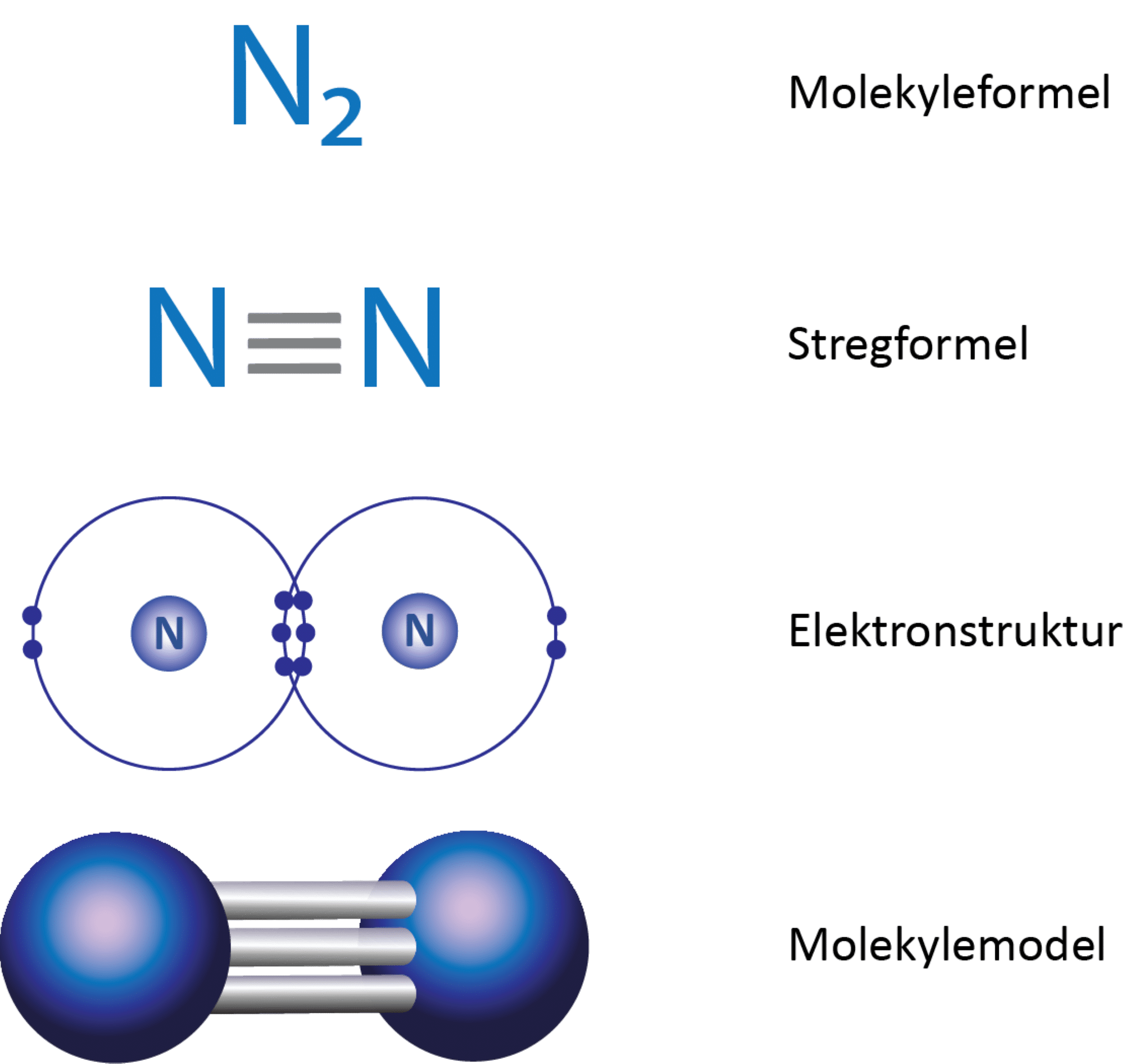
De to oxygenatomer er bundet sammen med en dobbeltbinding. I figur 5 ses det i elektronprikformlen, at hvert oxygenatom deler 4 elektroner med det andet oxygenatom, og da der skal to elektroner til for at danne en binding, svarer det netop til en dobbeltbinding. Dermed opfyldes oktetreglen for begge atomer i molekylet.
Opbygning:
Dioxygen er et diatomigt molekyle og er derfor lineært. Molekylet er upolært, da atomerne er ens og derfor har samme elektronegativitet. Dermed bliver forskellen i elektronegativitet 0:
EN(O) = 3,5
ΔEN = 0,0
Fysiske og kemiske egenskaber:
I figur 6 ses forskellige fysiske egenskaber for dioxygen. Selvom molekylet er upolært, opløses der tilstrækkeligt af gassen i rent vand ved stuetemperatur og normalt tryk til, at dioxygen-krævende organismer som dyr og planter kan leve i havet. Jo højere temperatur vandet har, jo mindre dioxygen kan der opløses deri.

Dioxygen er i modsætning til dinitrogen temmelig reaktivt. Hvorfor den store forskel? På B-niveau lærer du om forskellen mellem de to molekyler ud fra deres bindinger: Dinitrogen har en stærk trippelbinding og er derfor meget stabilt, mens dioxygen har en dobbeltbinding og nogle uparrede elektroner, hvilket gør det mere reaktivt.
Hvis du senere får kemi på A-niveau eller læser kemi på universitetet, udvider du din forståelse af atommodeller. Her lærer du om orbitaler og hvordan de overlapper og danner molekylorbitaler. Med den viden kan man forklare mere præcist, hvorfor dioxygen er så reaktivt, mens dinitrogen ikke er.
Fun facts:
1. Uden dioxygen ingen brand!
Før noget kan brænde, kræver det tre ting, som du kan se i brandtrekanten i figur 7.

Fjerner du enten brændstoffet, varmen eller dioxygenen, stopper branden. Når du lægger låg på en gryde, hvor der er gået ild i olien, eller du lukker for vinduerne ved en ildebrand, fjerner du dioxygenen, og ilden går efterhånden ud.
2. Hvorfor trækker vi vejret?
Dioxygen er livsvigtigt for mange levende organismer på jorden. Nu tænker du måske, at det er, fordi vi skal bruge det til at trække vejret. Det er rigtigt nok, men hvorfor trækker vi vejret? Det er, fordi vi skal bruge dioxygenen til at forbrænde vores mad i kroppen, så vi kan få energi ud af det, vi spiser. Det handler om redoxreaktioner, som du kan læse mere om i temaet ’Fremtidens batterier – C-niveau’ eller senere i de reaktioner, der sker i atmosfæren.
3. Ilt skifter farve
Du kan danne flydende dioxygen ved at køle det tilstrækkeligt langt ned ved hjælp af flydende nitrogen, som du kan se her. Selvom det ikke er tydeligt i filmen, er både flydende og fast dioxygen lyseblåt, mens gassen er farveløs.
4. Hvorfor har bjergbestigere brug for iltflasker?
Som du kan se i figur 1 ovenfor, er der ca. 21 % dioxygen i atmosfærisk luft. Det er en koncentration, som vores kroppe har tilpasset sig til, når vi trækker vejret. Men bjergbestigere, som bestiger verdens højeste bjerge som Mount Everest, har som regel iltflasker med, fordi koncentrationen af dioxygen falder, jo længere op i atmosfæren, du kommer. Du kan læse her, hvorfor det som regel er nødvendigt.
Du har fået forskellige oplysninger om dioxygen ovenfor. Nu skal du sammen med en makker prøve at se, hvor meget I til sammen kan huske og har forstået om molekylet. I må ikke kigge ovenfor.
Se mere
Ædelgasserne befinder sig i 18. gruppe svarende til 8. hovedgruppe i det periodiske system. På nær helium, der har 2 elektroner i yderste skal, har ædelgassernes atomer 8 elektroner i yderste skal. Derfor er de meget stabile og indgår som regel ikke i kemiske reaktioner i luften. Du kan i denne film lære om ædelgasserne og deres anvendelser:
Måske har du lagt mærke til, at elektronerne, der er tegnet i elektronstrukturerne i figur 2 og 5, tegnes parvist sammen. Elektroner tegnes som par, fordi de normalt findes to og to i samme orbital, som du kan lære mere om på A-niveau i kemi. Men i nogle atomer, fx carbon med fire elektroner i yderste skal, er nogle elektroner uparrede, indtil de danner bindinger med andre atomer. Prøv at se starten af filmen igen og se, hvordan elektronstrukturen blev tegnet for ædelgasserne.
Se mere
I Danmark kender de fleste nok bedst helium, som er velegnet til at puste balloner op, som holder sig svævende, fordi helium er lettere end atmosfærisk luft (se figur 8). Nogle mennesker indånder lidt af gassen fra en oppustet ballon som underholdning og får en sjov, lys stemme. Men det frarådes at prøve det, for selvom helium ikke er giftigt, fortrænger det dioxygenen, du har brug for, og dermed kan du blive svimmel og besvime.

Ædelgassen radon er radioaktiv, som du så i filmen. Når man bor i hus, er der risiko for, at radon, som findes i vores undergrund, siver op gennem revner og sprækker bygningernes fundament. Gassen er farveløs og lugter ikke, du ville ikke lægge mærke til den. Radon er den næsthyppigste årsag til lungekræft, og man ved, at omkring 300 i Danmark dør pga. radon om året. Der er heldigvis krav om radonsikring ved bygning af nye boliger, og bor man i en ældre bolig, kan man også få lavet radonsikring, hvis ens bolig ligger i et område af Danmark, der er udsat.
En drivhusgas er en gas i atmosfæren som carbondioxid og methan, som absorberer og udsender varmestråling også kaldet infrarød stråling. Længere nede kan du læse mere om drivhuseffekten, og hvorfor nogle gasser absorberer og udsender varmestråling, mens andre ikke gør. Blandt de mere almindeligt kendte drivhusgasser er carbondioxid og methan. Methan udledes bl.a. fra køer, når de bøvser og prutter, da de har mikroorganismer i deres fordøjelsessystem, som netop producerer denne gas. Blandt mindre kendte drivhusgasser er vand og ozon. Herudover er der dinitrogenmonoxid, som er bedre kendt som lattergas, og CFC-gasser, som er carbonforbindelser med fluor og chlor.
Navn:
Carbondioxid eller kuldioxid er navnet, du bruger i kemi. I gamle dage kaldte man det kultveilte (’tve’ og ’di’ refererer begge til de to oxygenatomer).
Bindingstyper:
Elektronparbindinger, også kaldet kovalente bindinger, holder atomerne sammen.
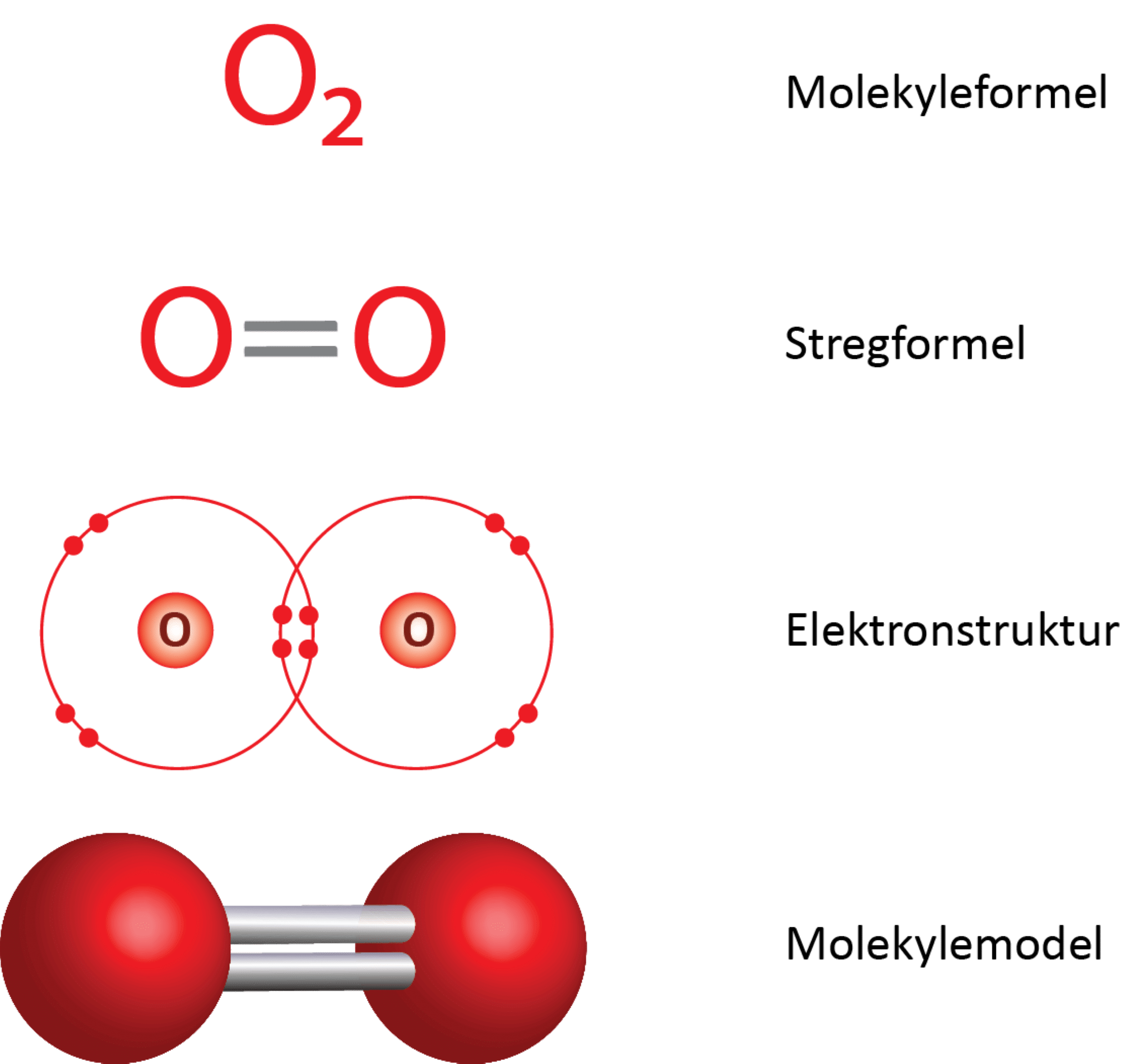
Hvert oxygenatom er bundet til det centrale carbonatom med dobbeltbindinger. I figur 9 ses det i elektronprikformlen, at hvert oxygenatom deler 4 elektroner med carbonatomet, og da der netop skal to elektroner til for at danne en binding, svarer det til en dobbeltbinding.
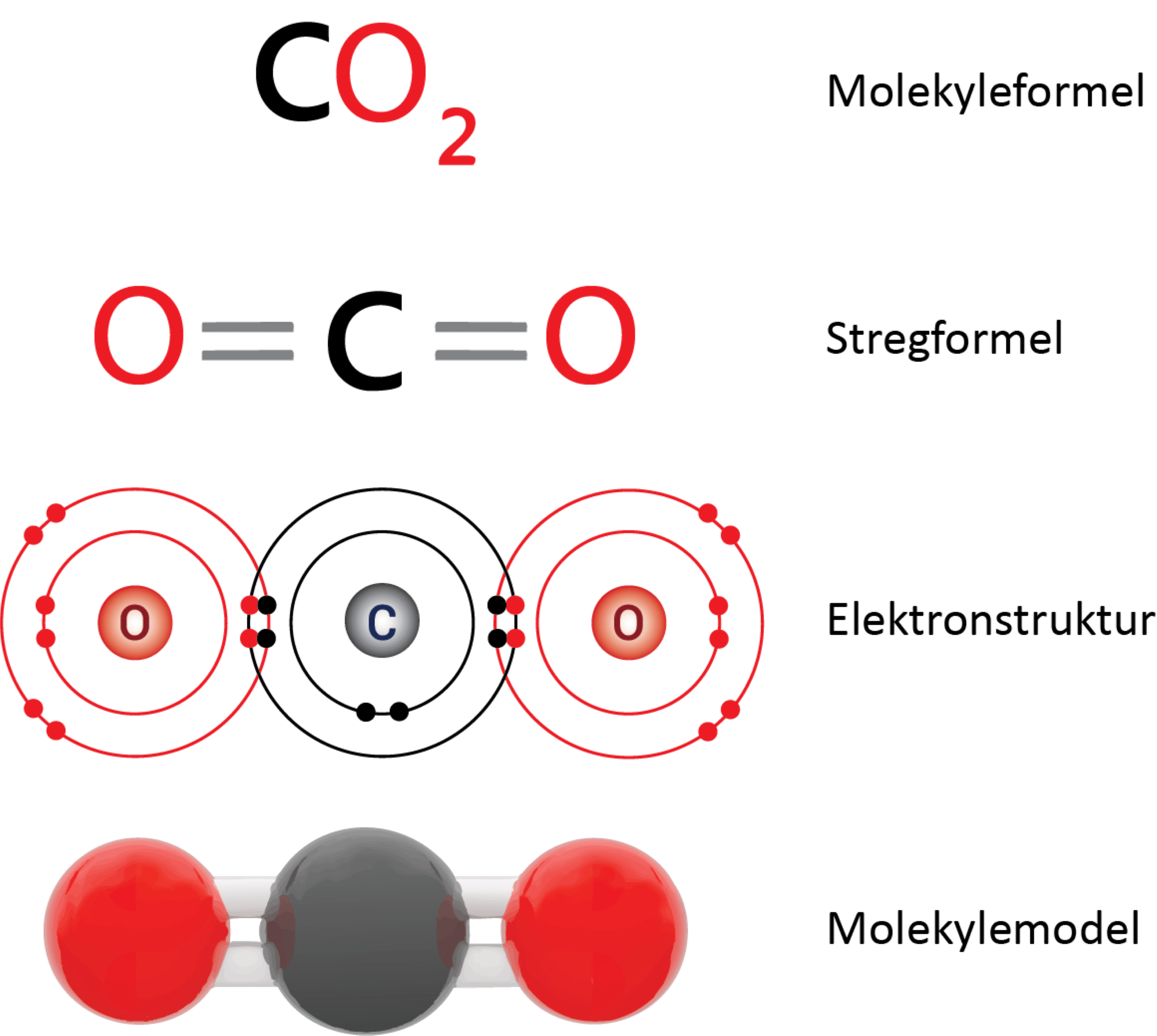
Opbygning:
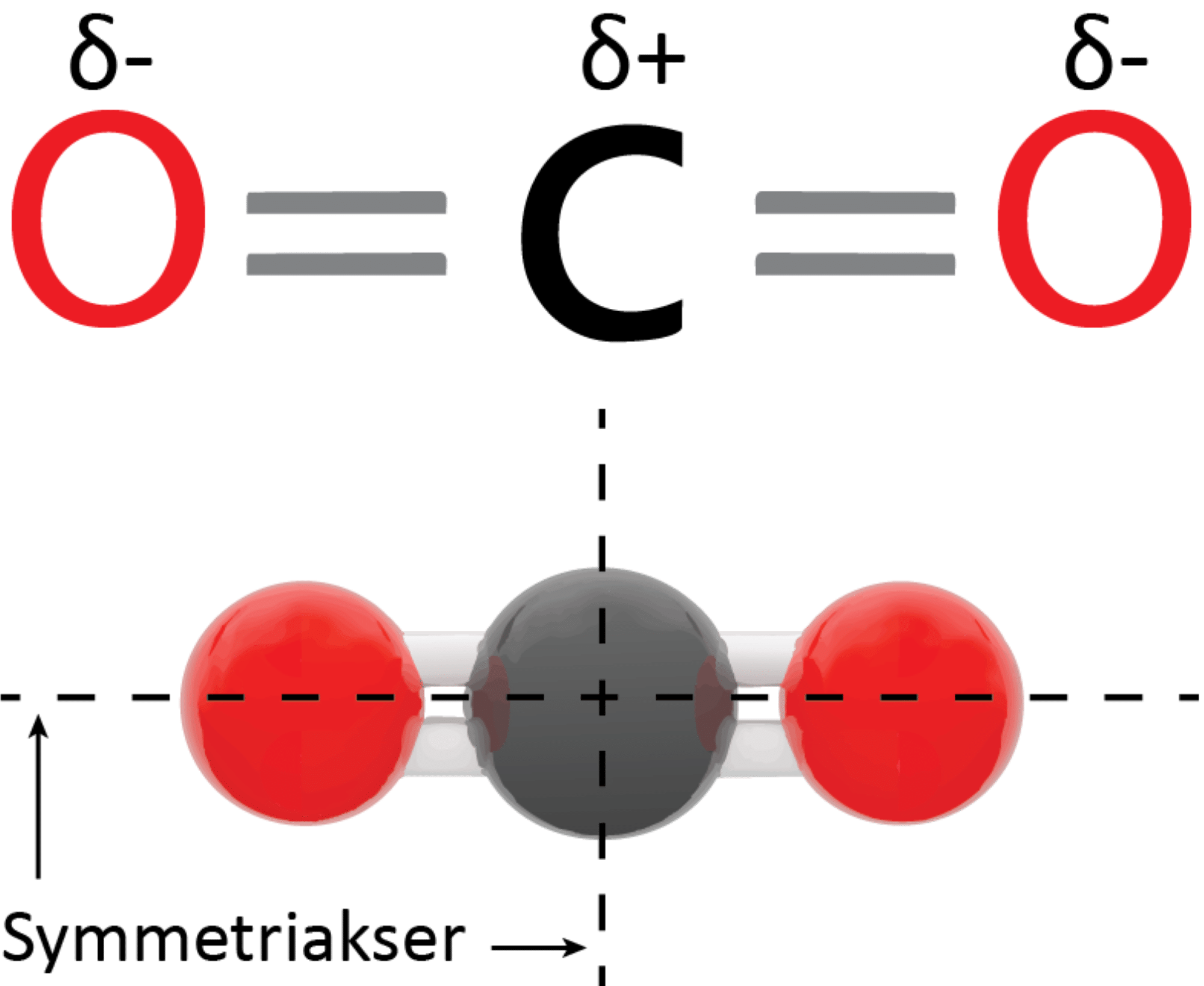
Molekylet er lineært, hvilket betyder, at alle tre atomers centrum ligger på en ret linje. Herudover er molekylet symmetrisk (se figur 10) og dermed upolært, selvom begge dobbeltbindinger hver især er polære. Det bliver tydeligt, når forskellen i elektronegativitet beregnes:
EN(C) = 2,5
EN(O) = 3,5
ΔEN = 1,0
Fra beregningen kan det konkluderes, at dobbeltbindingerne hver især mellem carbon- og oxygenatomerne er polære.
Fysiske egenskaber:
I figur 11 ses forskellige fysiske egenskaber for carbondioxid. Da carbondioxid sublimerer, dvs. går fra fast form direkte til gas uden at være på flydende form, har stoffet ikke et smeltepunkt ved normalt tryk (1 atm.). Koncentrationen af carbondioxid i atmosfæren har været målt i mange år, og her kan du se, hvordan den er steget gennem de sidste cirka 60 år. I år 2000 var koncentrationen af CO₂ i atmosfæren fx 369,71 ppm (parts per million). Opløseligheden af CO₂ i vand afhænger blandt andet af vandets vandets temperatur og er meget højere end for dinitrogen og dioxygen.

Fun facts:
Når carbondioxid er på fast form, kaldes det for tøris. Dette hænger sammen med, at carbondioxid ikke smelter og bliver ’vådt’ ligesom is bliver til vand, før det fordamper. I stedet for sublimerer det. Da det samme antal molekyler på gasform fylder væsentlig mere end på fast form, kan man lave en mekanisk eksplosion, som du kan se Peter Hald fra Aarhus Universitet, udføre her:
Tøris har mange funktioner ifølge et firma, der sælger det:

Du har fået forskellige oplysninger om carbondioxid ovenfor. Nu skal du sammen med en makker prøve at se, hvor meget I til sammen kan huske og har forstået om molekylet. I må ikke kigge ovenfor.
1. Forklar, hvorfor hvert oxygenatom i carbondioxidmolekylet er bundet til carbon med en dobbeltbinding.
2. Molekylet har to polære bindinger. Hvorfor er CO₂ alligevel upolært?
3. I figur 11 er koncentrationen af carbondioxid i luften angivet 424,61 ppm (volumenkoncentration). Denne værdi skal du omregne til koncentrationsenheden g/L, så du kan sammenligne med opløseligheden af carbondioxid i vand ved 25 °C, der er 1,45 g/L. Til dette skal du bruge idealgasligningen.
Idealgasligningen viser sammenhængen mellem tryk, volumen, stofmængde og temperatur, lyder:![]()
p er gassens tryk i atm, V er gassens volumen i L, n er stofmængden af gassen i mol, T er gassens temperatur i K, og R er en proportionalitetskonstant kaldet gaskonstanten. Den har samme værdi for alle gasser:
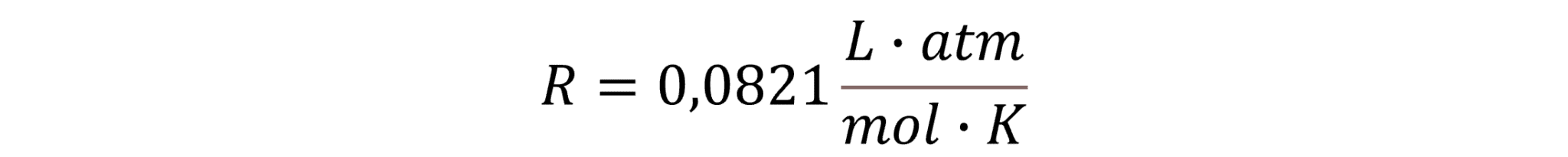
a. Omskriv formlen
![]()
så du har et udtryk for n og indsæt det i idealgasligningen i stedet for stofmængden.
b. Isolér massen, m, i ligningen.
c. Molarmassen, M, for carbondioxid er 44,01 g/mol. Antag at trykket er 1 atm og temperaturen er 25 °C. Omregn temperaturen til enheden K.
d. Koncentrationen af carbondioxid i luften er 424,61 ppm, hvilket betyder, at der er 0,00042461 L CO₂ i 1 L luft. Beregn massen af carbondioxid i 1 L luft.
e. Er koncentrationen af carbondioxid i luft større eller mindre end 1,45 g/L, som er opløseligheden i vand?
4. Hvad fortæller udviklingen i CO₂-udledning i perioden 1940-2024 dig om menneskers påvirkning af atmosfæren? Kan du se en effekt af COVID 19-pandemien?
Se mere
Navn:
Methan er navnet, du bruger uanset om det er i kemitimerne eller udenfor.
Bindingstyper:
Elektronparbindinger holder atomerne sammen.
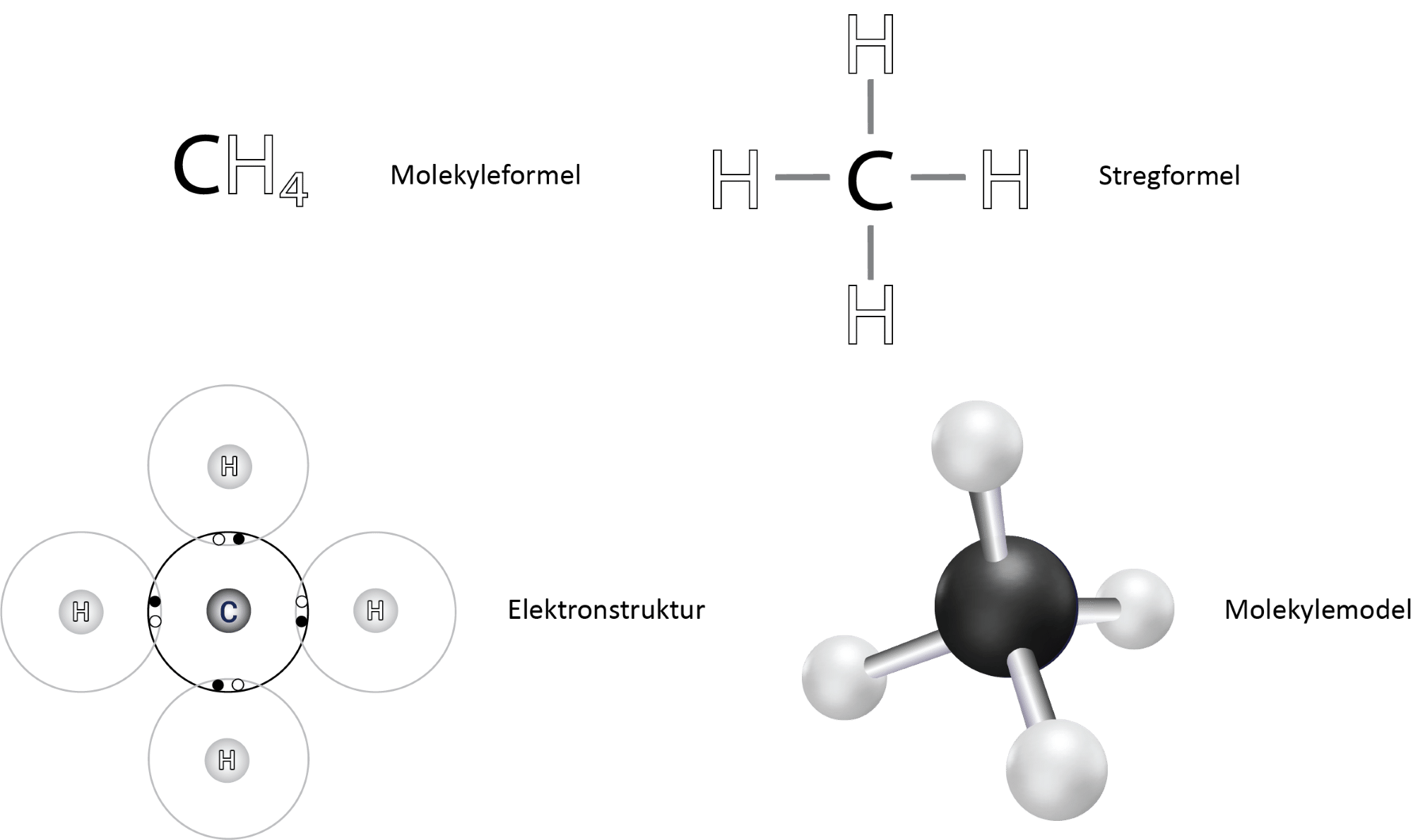
Det centrale carbonatom har fire enkeltbindinger til hver af hydrogenatomerne. I figur 13 ses det i elektronprikformlen, at hvert hydrogenatom deler 2 elektroner med carbonatomet, og da der netop skal to elektroner til for at danne en binding, svarer det til en enkeltbinding.
Opbygning:
Bindingsvinklen mellem to bindinger i methan er 109,5°, og med i alt 4 bindinger bliver molekylet et tetraeder. Det betyder, at de fire (tetra) hydrogenatomer danner fire flader. På engelsk er ordet tetrahedron, og hedron er det græske ord for flade. I figur 14 kan du se et tetraeder:

Bindingerne mellem carbon og hydrogen er upolære, da forskellen i elektronegativitet er under 0,5. Du kan læse mere om, hvordan du skelner mellem forskellige typer af kemiske bindinger i temaet ’Den tredje dimension’.
EN(C) = 2,5
EN(H) = 2,1
ΔEN = 0,4
Alle fire bindinger er altså upolære, og herudover er molekylet symmetrisk (se molekylemodellen i figur 13) og dermed bliver molekylet upolært.
Fysiske og kemiske egenskaber:
I figur 15 ses forskellige fysiske egenskaber for methan. Selvom molekylet er upolært, kan der opløses en smule af gassen i vand, men meget mindre end carbondioxid. Jo højere temperatur vandet har, jo mindre methan kan der opløses deri.

Methan tilhører gruppen af organiske stoffer, der hedder alkaner, og de er relativt reaktionstræge. De kan dog deltage i en reaktionstype kaldet substitutionsreaktion, som du kan læse mere om i temaet ’Nye lægemidler med et klik’. Herudover brænder stoffet rigtig godt:
CH4(g) + 2 O2(aq) → CO2(g) + 2 H2O(g)
(1)
Når der er dioxygen til stede, dannes der kun carbondioxid og vand ved forbrændingen.
Fun facts:
Døren til helvede
I området Darvaza i Turkmenistan findes ’Døren til helvede’. Det er et stort, brændende krater, der opstod, da man i 1971 borede efter olie og gas i området. I den forbindelse ramte man en stor gaslomme, hvor loftet brasede sammen. Man var bange for, at der kom giftige gasser ud derfra, så man satte ild til det, uden at man havde nogen fornemmelse for, hvor meget gas der var dernede. Lige siden har ilden brændt, men i dag (august 2025) er ilden næsten slukket, da man har tømt gassen ved at bore ned i luftlommen tæt på det åbne krater. Det er godt for klimaet, men landet mister samtidig en stor indtægtskilde, da det brændende krater var landets største turistattraktion. I figur 16 kan du se, hvordan det brændende krater så ud tidligere.

Der er en lang række facts om molekylet, som du sammen med en sidemakker skal finde frem til. I kan finde inspiration her til, hvad I kan søge videre på. I skal finde fem forskellige facts om molekylet, som I bagefter præsenterer for en anden gruppe.
Se mere
Du har fået forskellige oplysninger om methan ovenfor. Nu skal du sammen med en makker prøve at se, hvor meget I til sammen kan huske og har forstået om molekylet. I må ikke kigge ovenfor.
Se mere
Navn:
Vand er navnet, du bruger uanset om det er i kemitimerne eller udenfor. Hvis du skulle bruge et meget systematisk navn, hedder molekylet også dihydrogenoxid.
Bindingstyper:
Elektronparbindinger holder atomerne sammen.
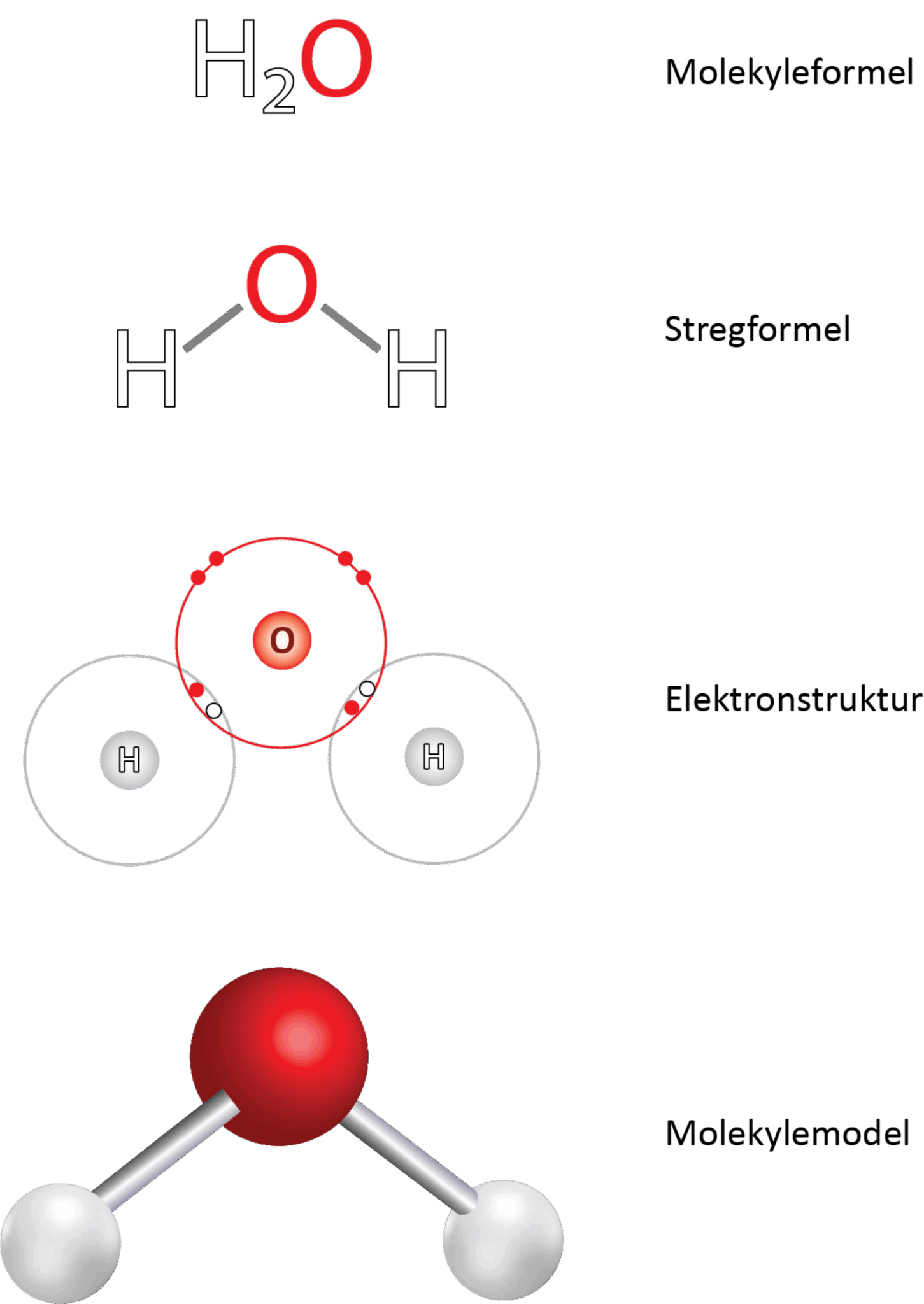
Det centrale oxygenatom har to enkeltbindinger til hver af hydrogenatomerne. I figur 17 ses det i elektronprikformlen, at hvert hydrogenatom deler 2 elektroner med oxygenatomet, og da der netop skal to elektroner til for at danne en binding, svarer det til en enkeltbinding.
Opbygning:
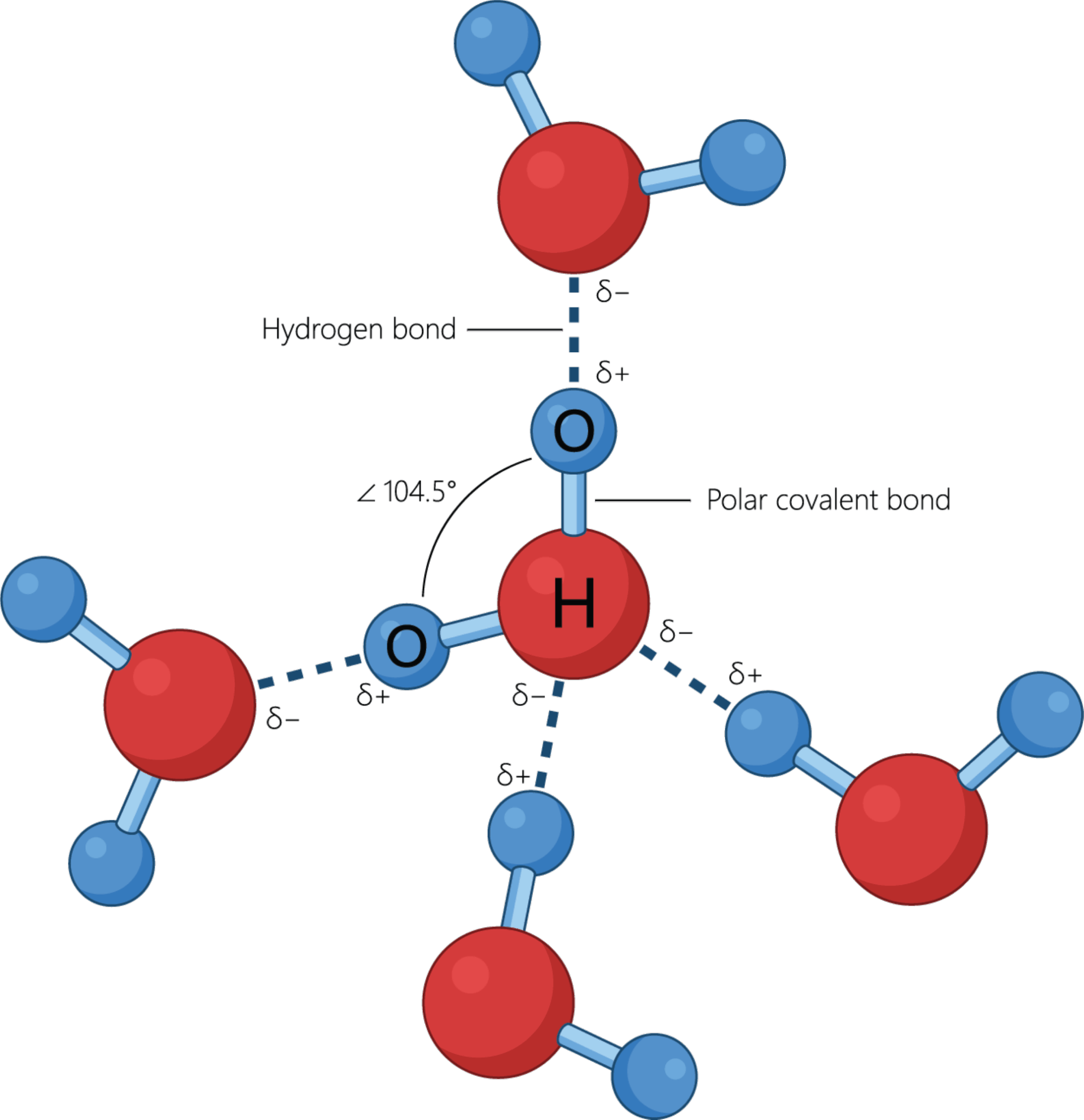
Bindingsvinklen mellem de to bindinger er 104,5°, så vandmolekylet er vinklet og ikke lineært, som man måske kunne tro. Hvis du har prøvet at bygge molekylet med et molekylebyggesæt, ser det ud til, at molekylet er plant. Et plant molekyle har nemlig alle atomer liggende i et plan. Men oxygenatomet har to frie elektronpar, som du kan se i elektronstrukturen i figur 17, og da elektronpar frastøder hinanden pga. den negative ladning, sidder de længst væk fra de to bindinger til hydrogen som muligt. Elektronskyerne (orbitalerne) for de frie elektronpar er overraskende store, som du kan se i figur 18, og de udgør 2 af de 4 hjørner i et tetraeder, mens de to hydrogenatomer udgør de to andre. Dermed er molekylets opbygning tetraederisk ligesom methan. De to frie elektronpar presser de to enkeltbindinger til hydrogenatomerne lidt tættere på hinanden, så bindingsvinklen bliver en anelse mindre end de 109,5° i methanmolekylet.
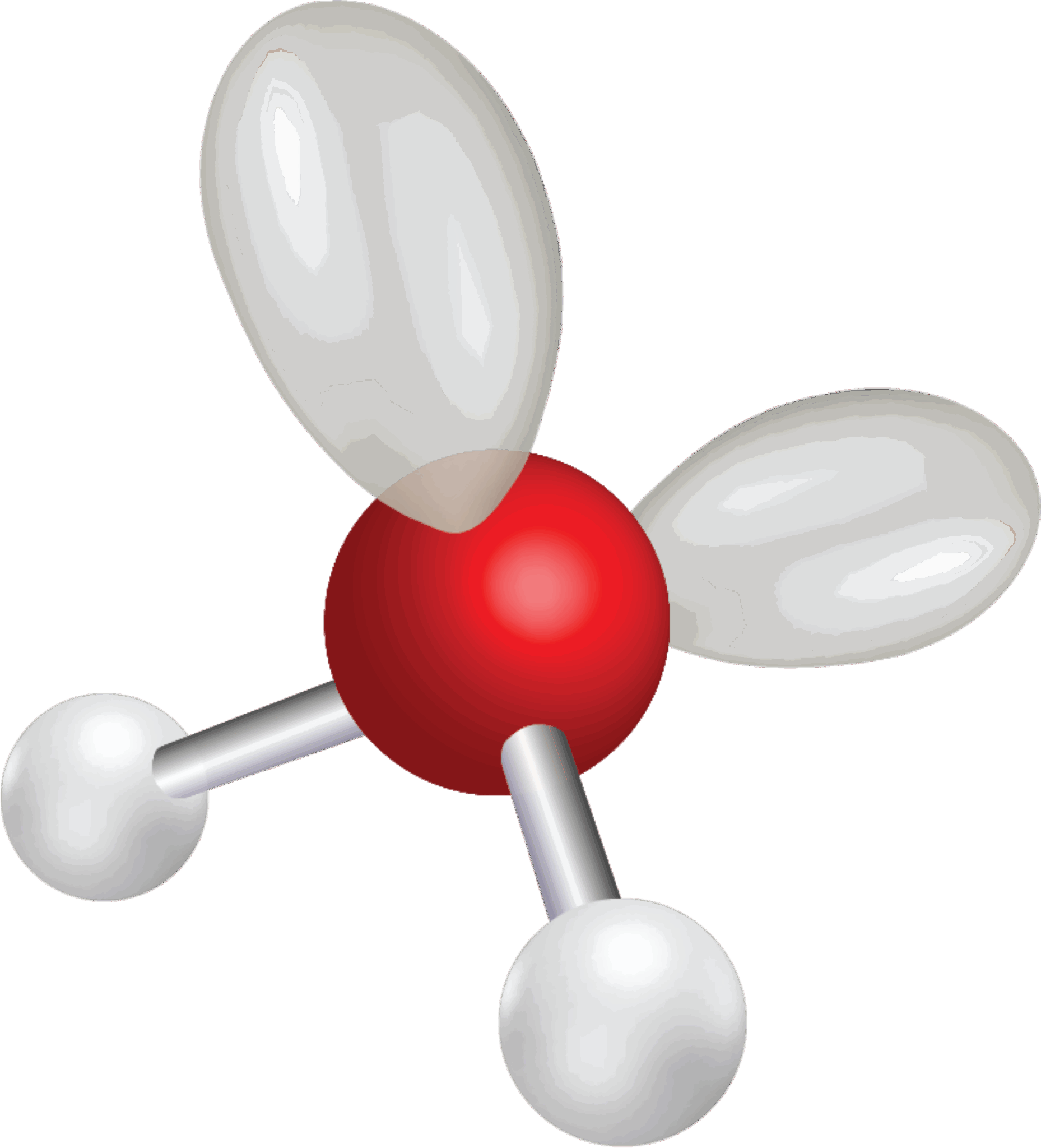
Bindingerne mellem oxygen og hydrogen er polære, da forskellen i elektronegativitet er over 0,5.
EN(C) = 3,5
EN(H) = 2,1
ΔEN = 1,1
Da oxygen har en højere EN-værdi end hydrogen, vil det fælles elektronpar være forskudt mod oxygen for begge hydrogenatomer. Dermed bliver der en øget negativ ladning i den side af molekylet, hvor oxygenatomet er, og der er en øget positiv ladning i den side af molekylet, hvor hydrogenatomerne er. Da der ikke er tale om en hel elektron, men kun en ladningsforskydning, bruger man det græske bogstav, delta (δ), med et plus eller minus bagefter for at angive dette, som du kan se i figur 19.
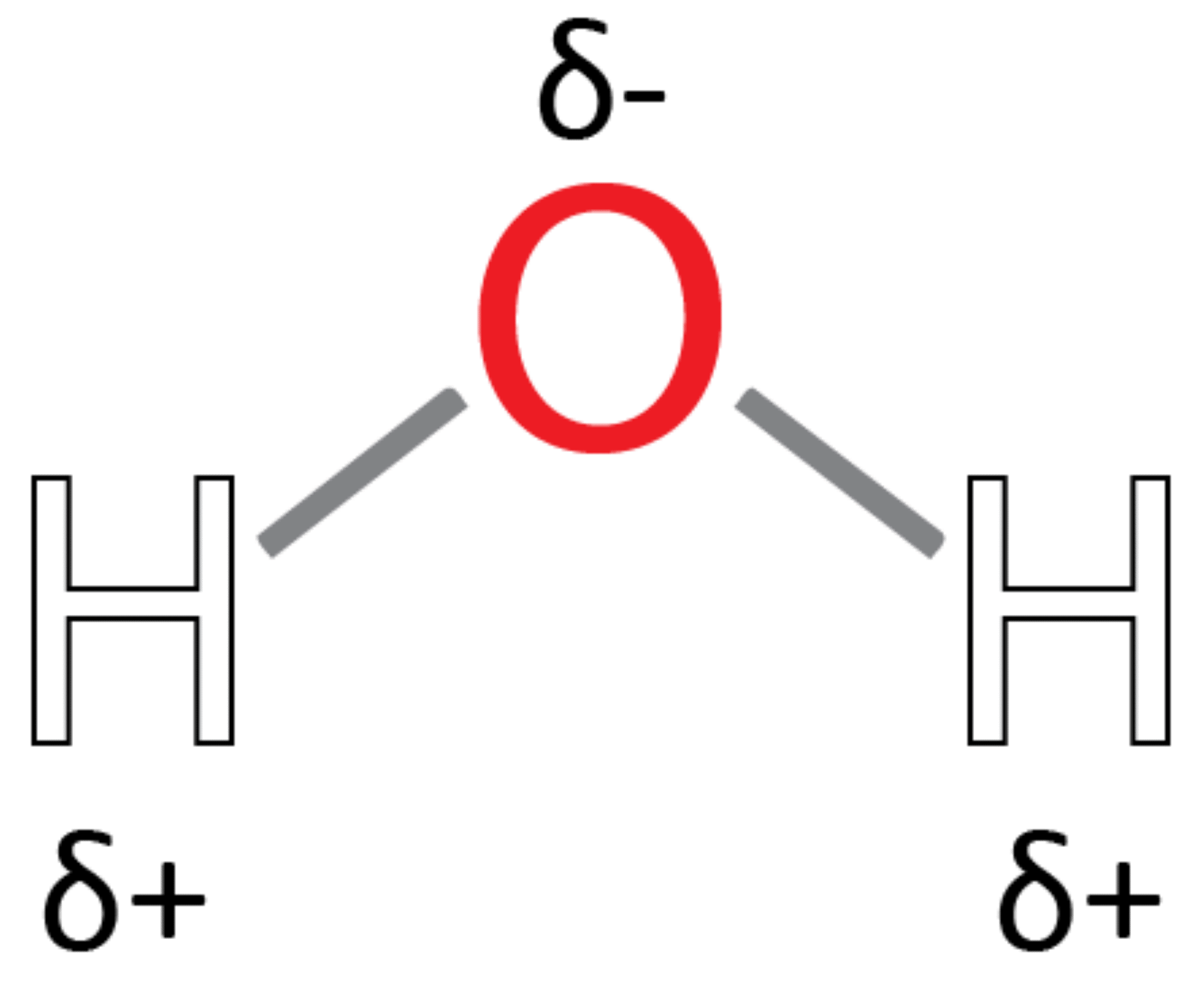
Fysiske og kemiske egenskaber:
I figur 20 ses forskellige fysiske egenskaber for vand. Koncentrationen af vanddamp i atmosfæren afhænger af temperaturen. Jo højere temperatur, jo højere koncentration. Ofte taler man om luftfugtighed, når man taler om vanddamp.

Da molekylet er polært, fungerer det som et godt opløsningsmiddel for andre polære stoffer og ionforbindelser. En anden egenskab ved vandmolekyler er, at danner hydrogenbindinger til hinanden. Hydrogenatomerne i et vandmolekyle er nemlig i underskud på elektroner pga. oxygenatomets høje EN-værdi, og derfor tiltrækkes de af de frie elektronpar på oxygenatomerne i nabomolekylerne. I figur 21 kan du se, hvordan vandmolekyler holdes sammen af hydrogenbindinger.
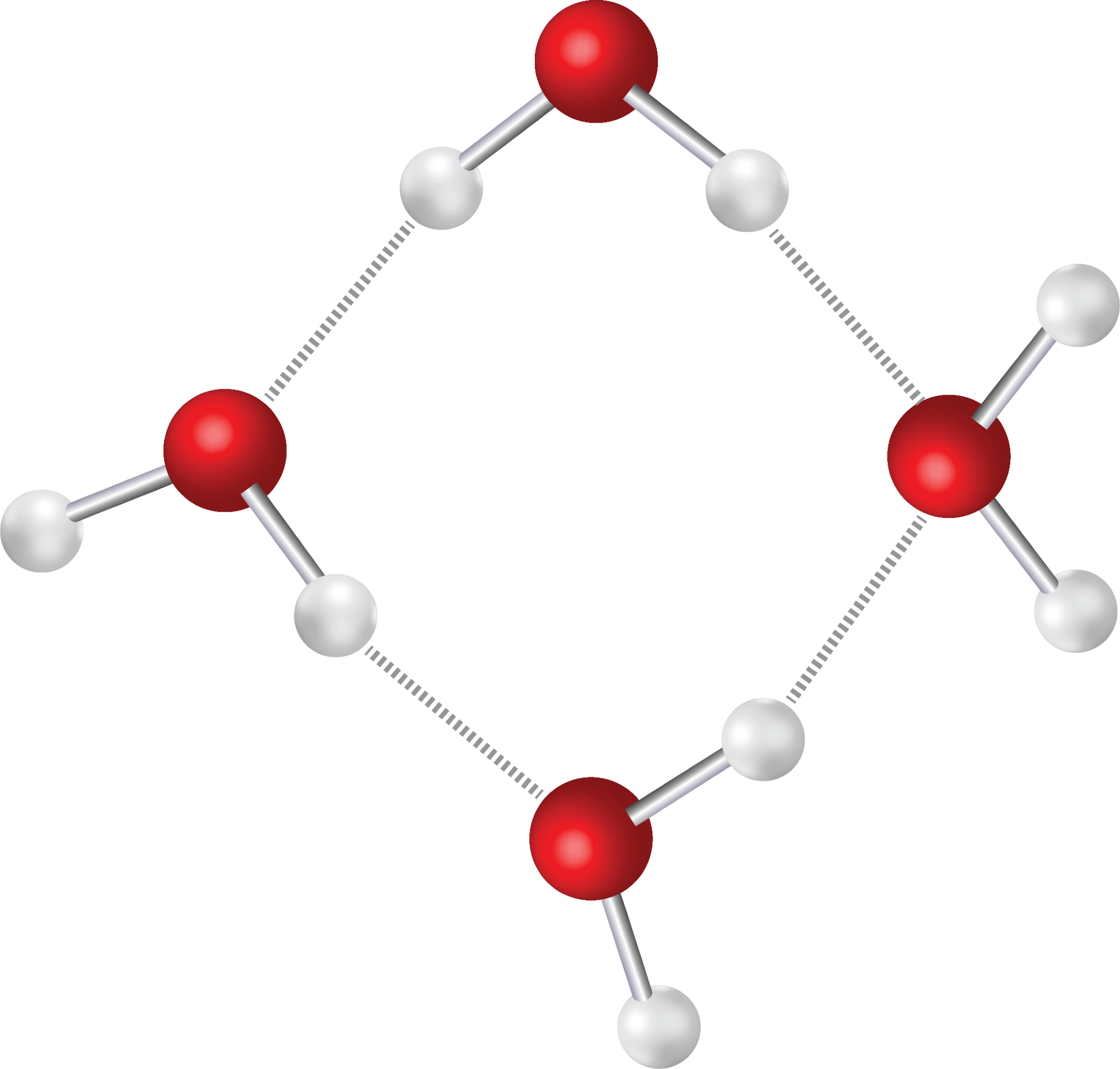
Hydrogenbindinger gør, at selvom vandmolekylet er lille, så er det tiltrukket af nabomolekylet i så høj grad, at både smelte- og kogepunktet for vand er relativt højt sammenlignet med fx dihydrogensulfid (H2S), som er et større men sammenligneligt molekyle. Dihydrogensulfid danner ikke hydrogenbindinger, og derfor er kogepunktet faktisk så lavt som -60,7 °C.
Fun facts:
1. Uden vand – intet liv?
Vand er en betingelse for liv, så vidt vi ved. Det har du nok hørt før, og måske har du også hørt, at når forskere leder efter tegn på liv udenfor jorden – fx på Mars – leder man efter vand. Alle levende organismer, som vi kender, har brug for vand på flydende form, hvilket normalt er mellem 0-100 °C. Vand fungerer som et unikt opløsningsmiddel, hvor de fleste af cellernes kemiske reaktioner kan foregå. Vand transporterer næringsstoffer og affaldsstoffer, stabiliserer temperaturen gennem sin store varmekapacitet og hjælper med at opretholde cellers struktur gennem osmose og hydrogenbindinger. Uden vand ville de biokemiske processer, der opretholder liv, simpelthen ikke kunne finde sted.
2. Is redder livet i søer og hav
Når de fleste stoffer går fra væske til fast form, er deres massefylde som regel større. Fx falder fast jern til bunds i flydende jern. Men når vand fryser til is, flyder det ovenpå vandet. Det sker, fordi vandmolekylerne pakker sig systematisk og har en masse luftkanaler, og dermed bliver isens massefylde lavere end vand. Det kan du se i denne film om vands tilstandsformer. Det er heldigt for livet i søerne og havene, for ellers ville vandet fryse fra bunden, og fisk og andre levende organismer ville dø (se figur 22). Når isen lægger sig ovenpå vandet, isolerer det faktisk, så vandet på bunden ikke fryser.
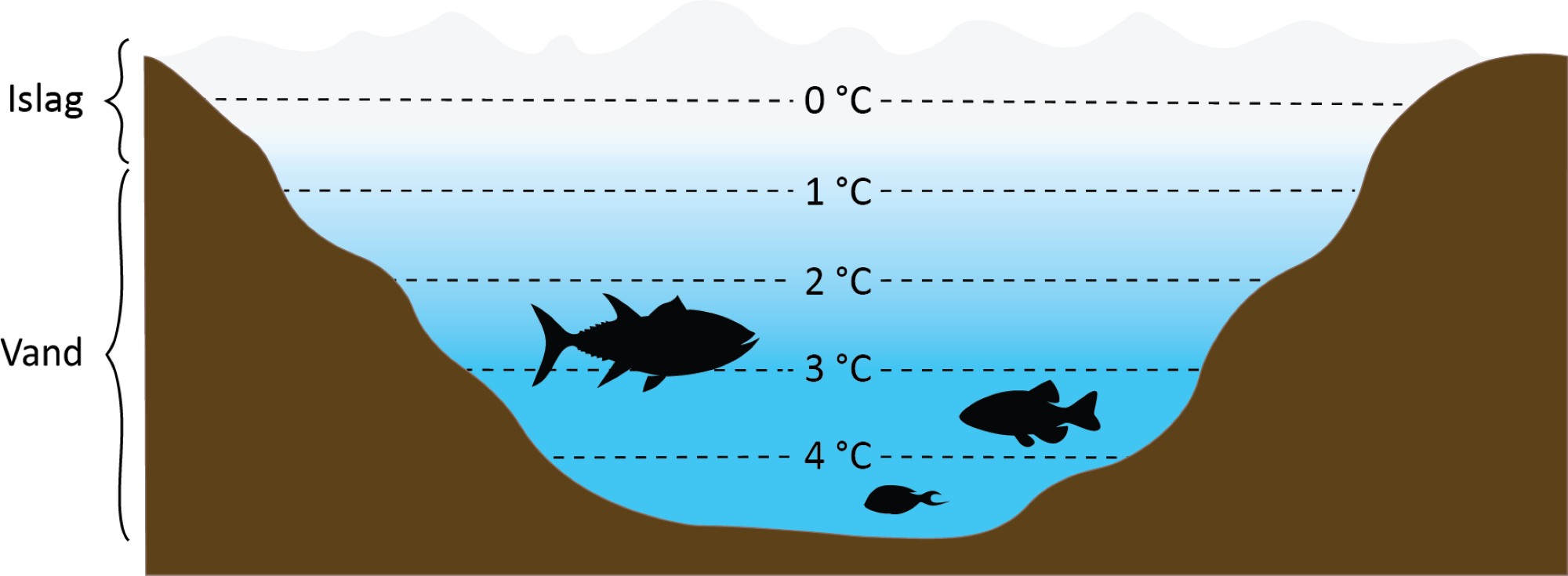
vand er så vigtigt, at man siden 2010 har vedtaget, at adgang til rent vand og sanitet er en menneskerettighed? Denne ret indebærer adgang til tilstrækkeligt, sikkert, acceptabelt, fysisk tilgængeligt og overkommeligt vand til personlig og husholdningsbrug samt sanitet og hygiejne.
Du har fået forskellige oplysninger om vand ovenfor. Nu skal du sammen med en makker prøve at se, hvor meget I til sammen kan huske og har forstået om molekylet. I må ikke kigge ovenfor.
1. Forklar, hvordan alle atomer i vandmolekylet får opfyldt oktetreglen.
2. Forklar, hvorfor molekylet er vinklet og har en tetraederisk opbygning.
3. Hvilken rolle spiller de frie elektronpar på oxygenatomet for molekylets form?
4. Forklar, hvad en hydrogenbinding er.
Se mere
Når du søger efter figurer på nettet til fx en præsentation i din klasse, skal du huske at være kritisk overfor, hvad den viser og hvor den kommer fra. Diskutér med din sidemakker, hvad problemet er i figur 23.
Se mere
Navn:
Trioxygen er navnet, som viser, hvordan molekylet er bygget op, men det kaldes for ozon.
Bindingstyper:
Elektronparbindinger holder atomerne sammen.
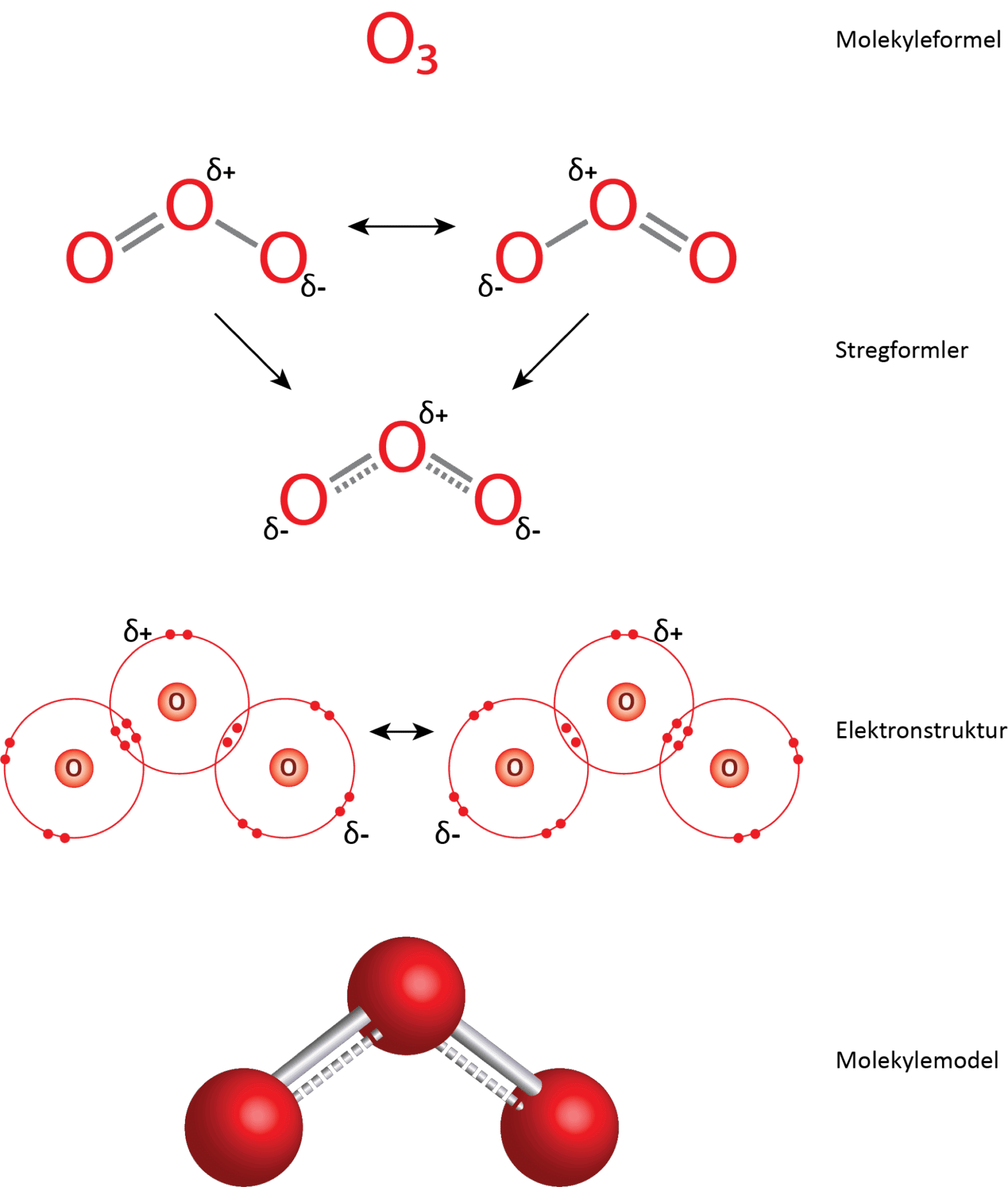
Hvis du skulle bygge ozon med et molekylebyggesæt, ville du hurtigt komme i problemer. Hver røde kugle, som repræsenterer oxygen, har kun to huller. Faktisk ville du kun kunne samle 3 oxygenatomer i en trekant, hvor hvert atom er bundet med en enkeltbinding til de to andre atomer. Men ozonmolekylet ser helt anderledes ud! Det er vinklet, og det centrale oxygenatom er faktisk bundet til de to andre atomer med halvanden elektronparbinding!
I figur 24 er der vist 3 stregformler. De to øverste viser såkaldte resonansformer. Resonansformer er forskellige måder at tegne elektronfordelingen i et molekyle på, når en enkelt struktur ikke kan beskrive elektronernes placering tilstrækkeligt. Molekylets egentlige struktur er en ’blanding’ af disse former, som den nederste stregformel viser. Resonansformerne er også vist i elektronstrukturen.
Opbygning:
Ozon er ligesom vand et vinklet molekyle, men bindingsvinklen mellem de to bindinger er 116,8° og derfor større end i vandmolekylet. Hvis du kigger på elektronstrukturen for ozon i figur 24, kan du se, at der kun er et enkelt frit elektronpar på det centrale oxygenatom. De resterende 3 elektronpar indgår i bindingen til de to andre atomer. Dermed vil elektronskyen for det frie elektronpar samt bindingerne til de to andre atomer ligge i et enkelt plan, og molekylet har en plan opbygning omkring det centrale oxygenatom. Hvis det frie og de 3 bindende elektronpar skal placeres længst væk fra hinanden i et plan, burde bindingsvinklen være 120°. Grunden til den er lidt mindre er samme som for vandmolekylet. Elektronskyen for det frie elektronpar presser de bindende elektronpar en smule tættere på hinanden.
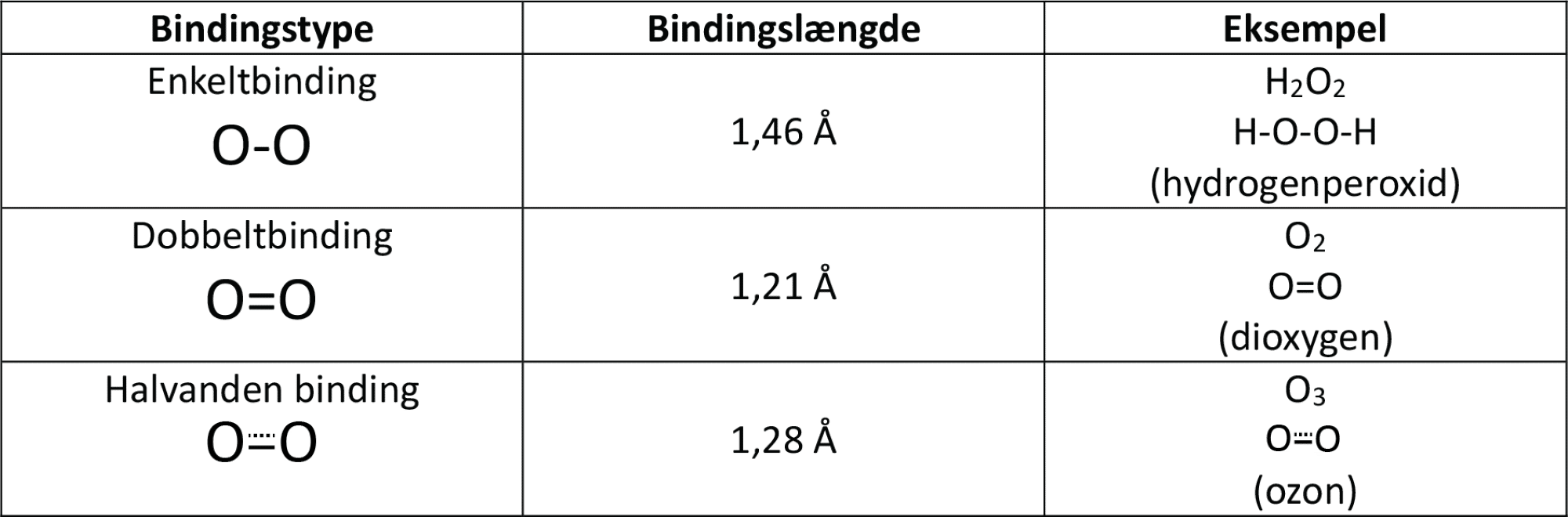
Længden af enkeltbindinger er større end for dobbeltbindinger, og det gælder også for bindinger mellem oxygenatomer, som du kan se i figur 5. Forskere har undersøgt bindingslængderne i ozonmolekylet og fundet ud af, at de er et sted midt imellem enkelt- og dobbeltbindinger. De svarer til halvanden binding.
Ozonmolekylet burde være upolært, da atomerne er ens og derfor har samme elektronegativitet. Dermed bliver forskellen i elektronegativitet præcis 0:
EN(O) = 3,5
ΔEN = 0,0
Men molekylet er polært! I opgave 9 længere nede får du en forklaring på det.
Fysiske og kemiske egenskaber:
I figur 26 ses forskellige fysiske egenskaber for ozon. Molekylet er polært og opløseligheden i vand er derfor stor. I stratosfæren mellem 20 og 30 km over jordens overflade topper koncentrationen af ozon i det såkaldte ozonlag, som beskytter os mod en del af solens farlige UV-stråler. Længere nede i troposfæren fra 0-15 km over jordens overflade er ozonkoncentrationen lavere (0,000001 %), men i meget forurenede byer er koncentrationen 7 gange større end dette. Det lyder ikke af meget, men ozon er faktisk sundhedsskadeligt.

Ozon er et meget reaktivt molekyle, fordi strukturen er ustabil. Ozon absorberer UV-strålerne fra solen, og molekylet omdannes til dioxygen og et frit oxygenatom.
O3(g) → O2(g) + O(g)
(2)
Det frie oxygenatom kan reagere med et andet oxygenatom og danne dioxygen, eller det kan gendanne ozon ved at reagere med et dioxygenmolekyle. Herudover er ozon et kraftigt oxidationsmiddel, så det kan reagere med andre stoffer i luften både højt oppe i atmosfæren og tættere på jordoverfladen.
Fun facts:
1. Ozonens dobbelte rolle
Ozon er både godt og skidt for os. Det afhænger af, hvor det befinder sig. Så længe det befinder sig højt oppe i stratosfæren, beskytter molekylet os delvist mod UV-stråling. Men nede ved jordoverfladen kan det dannes pga. forurening, og fordi det er så reaktivt, reagerer det med forskellige stoffer i luften og danner sundhedsskadelige partikler. De kan ende med at give irritation i luftvejene (astma og kronisk bronkitis) og emfysem, som er en kronisk lungesygdom, hvor man har vejrtrækningsproblemer.
2. Ødelæggelse og genopretning af ozonlaget
Måske har du hørt om huller i ozonlaget? Ellers spørg dine forældre, om de har hørt om det. Hvert år dannes der et hul i ozonlaget over Antarktis. Og for 50 år siden fandt man ud af, at udledning af menneskeskabte gasser (CFC-gasser, som du kan læse om længere nede) årtier inden, spillede en stor rolle i at øge størrelsen af hullerne i ozonlaget. På grund af en stor international indsats gennem mange årtier, er der nu godt nyt. Ozonlaget er på vej til at blive genoprettet. Det kan du læse mere om her.
3. Lugten af ozon
Nogle gange kan du lugte, at regn er på vej. Især ved tordenvejr. Det skyldes, at der dannes små mængder ozon. Navnet ozon kommer fra græsk og betyder at lugte. Den dejlige duft, du måske har lagt mærke til efter regnen, skyldes dog, at gas fra de øverste jordlag frigives.
I denne engelske video får du en forklaring på, hvorfor ozon er polært. Når du har set den, skal du sammen med din sidemakker forsøge at forklare på dansk, hvorfor ozon er polært. Du kan med fordel inddrage figur 24.
Se mere
Du har fået forskellige oplysninger om ozon ovenfor. Nu skal du sammen med en makker prøve at se, hvor meget I til sammen kan huske og har forstået om molekylet. I må ikke kigge ovenfor.
1. Forklar, hvorfor ozonmolekylet ikke kan beskrives med én enkelt strukturformel. Hvad viser resonansformerne?
2. Hvorfor siger man, at bindingerne i ozon svarer til halvanden binding?
Se mere
Navn:
Dinitrogenoxid er navnet, du bruger i kemi, for det beskriver molekylets opbygning. Molekylet kaldes i daglig tale også for lattergas, da man tidligt fandt ud af, at gassen kunne få folk til at grine.
Bindingstyper:
Elektronparbindinger, også kaldet kovalente bindinger, holder atomerne sammen.
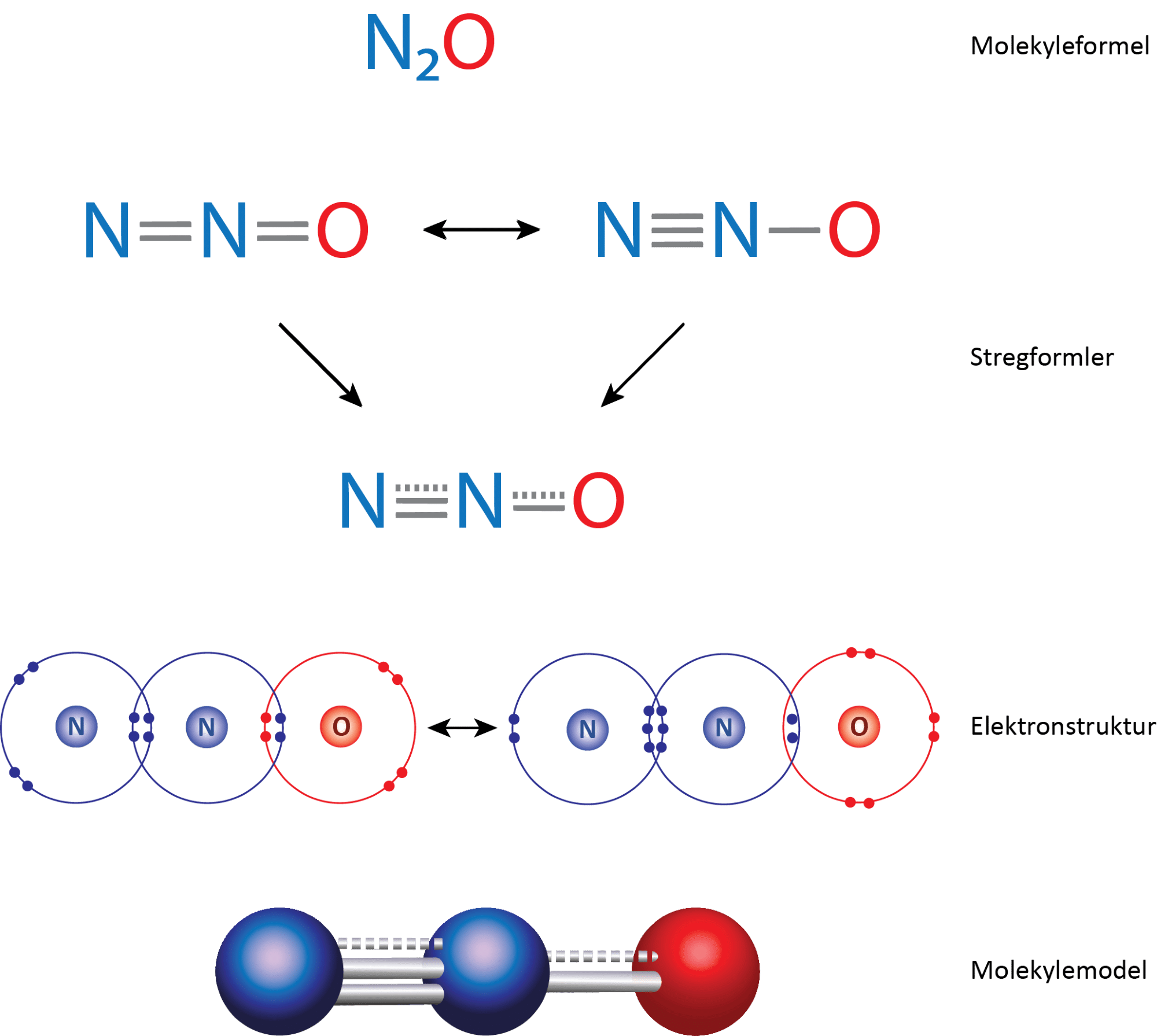
Hvis du skulle bygge dinitrogenoxid med et molekylebyggesæt, ville du få problemer med at få de tre huller i hvert nitrogenatom og de to huller i oxygenatomet fyldt ud. Det skyldes som med ozon, at molekylet findes som resonansformer, som du kan se i figur 27. Molekylets egentlige struktur er en ’blanding’ af disse former.
Opbygning:
Dinitrogenoxid er et tretomigt molekyle, hvor alle atomerne er bundet sammen med flere bindinger end enkeltbindinger (2,5 og 1,5). Derfor er molekylet lineært.
Ligesom du så for ozon, er længden af enkeltbindinger større end for dobbeltbindinger, der er større end trippelbindinger, og det gælder også for bindinger mellem nitrogenatomer, som du kan se i figur 28. Forskere har undersøgt bindingslængderne i dinitrogenoxidmolekylet og fundet ud af, at de er et sted midt imellem dobbelt- og trippelbindinger. De svarer til 2,5 binding.
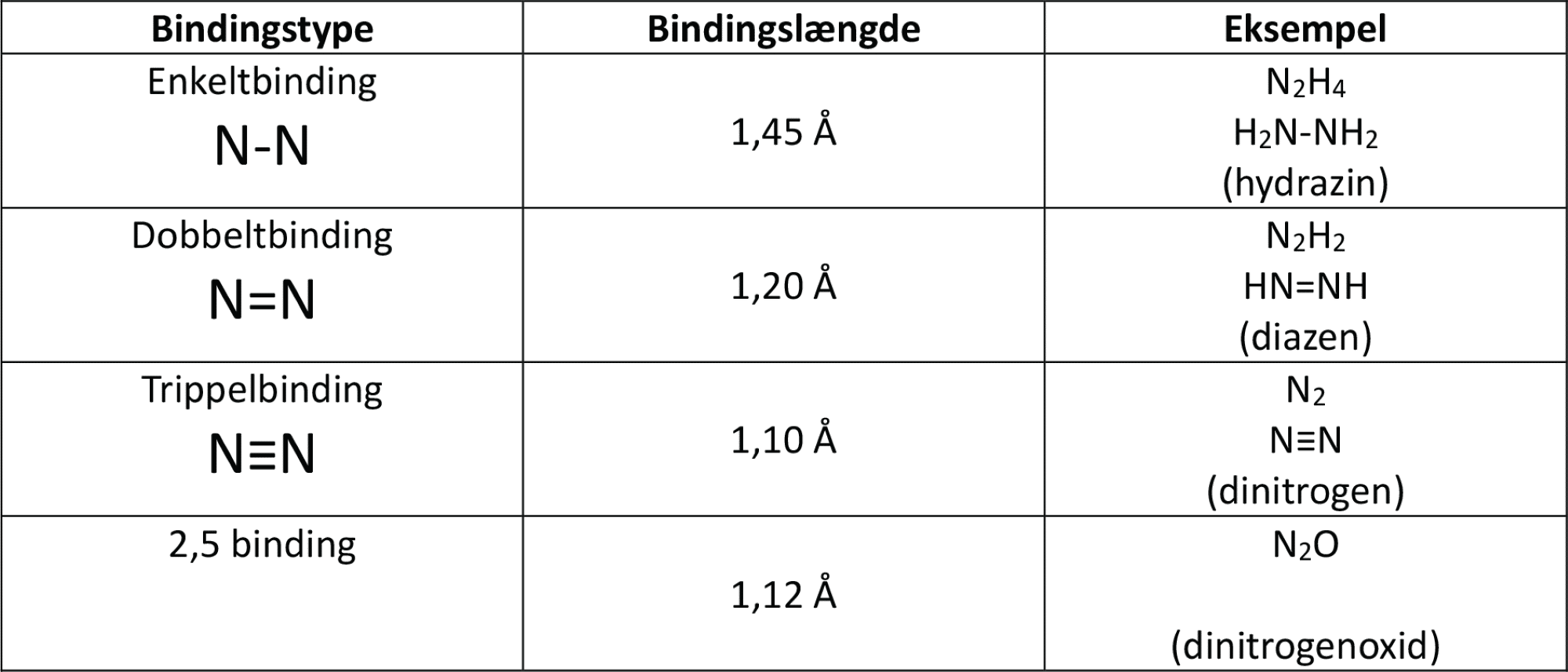
Molekylet er lige på grænsen mellem polært og upolært, da forskellen i elektronegativitet er 0,5 (se figur 4 i temaet ’Den tredje dimension – livets arkitektur’:
EN(O) = 3,5
EN(N) = 3,0
ΔEN = 0,5
Fysiske og kemiske egenskaber:
I figur 29 ses forskellige fysiske egenskaber for dinitrogenoxid. Selvom molekylet er på grænsen mellem polær og et upolær, opløses der ikke meget af gassen i vand ved stuetemperatur, når man tager udgangspunkt i den lave koncentration i atmosfæren. Jo højere temperatur vandet har, jo mindre dinitrogenoxid kan der opløses deri.

Elektronstrukturen for dinitrogenoxid er meget stabil, og molekylet reagerer praktisk taget ikke i den nedre del af atmosfæren kaldet troposfæren. Længere oppe i stratosfæren nedbrydes molekylet af solens UV-stråler, og det sætter gang i en række af reaktioner, der resulterer i nedbrydningen af ozonmolekylerne i ozonlaget.
Fun facts:
Lattergas har haft flere anvendelser gennem tiden, som du kan læse om her.
1. Lattergas finansierede udviklingen af revolveren
I starten efter opdagelsen af lattergas blev den brugt til at få folk til at grine. En god historie er, at opfinderen af Colt-revolveren manglede penge, og han endte derfor med at producere lattergas og tage rundt til velhavende kunder under påskud af at være læge og underholdt dem med lattergas. Herved tjente han nok penge til at kunne udvikle Colt-revolveren, der har en roterende cylinder, som du kan se i figur 30.

Colt producerede sin egen lattergas ved at opvarme ammoniumnitrat til knap 300 °C:
NH4NO3(s) → N2O(g) + H2O(g)
(3)
Colt vidste godt, at hvis han varmede ammoniumnitraten for meget op, ville det udvikle store mængder gasser, der hurtigt ville udvide sig med en eksplosion. Reaktion (4) er den dominerende reaktion ved opvarmning af ammoniumnitrat til højere temperaturer end den, Colt brugte.
NH4NO3(s) → 2 N2(g) + O2(g) + 4 H2O(g)
(4)
2. Bedøvelsesmiddel
I dag anvendes lattergas som almindeligt bedøvelsesmiddel hos både tandlæger og på fødestue. Gassen er relativt hurtigt ude af kroppen igen. Den gives som en blanding af 50% dioxygen og 50% dinitrogenoxid, så der er altså ikke tale om ren lattergas. Lattergassen er et effektivt bedøvelsesmiddel, fordi den er opløselig i fedt, og en del af din krop – især din hjerne – har meget fedt i sig.
3. Lattergas i køkkenet
Når lattergaspatroner i dag bruges i køkkenerne til bl.a. at opskumme fløde med, så er det også, fordi gassen er meget opløselig i fedt. Så den fløde, der kommer ud af sifonen (se figur 31), indeholder meget gas, og når trykket falder udenfor gaspatronen, udvider lattergassen sig meget, og det giver en god opskumningseffekt af fløden.

Den lette adgang til lattergaspatroner har dog skabt store misbrugsproblemer, som du kan læse lidt om i næste afsnit.
Hard facts:
Selvom lattergas har vigtige anvendelser i medicin og industri, bliver det også misbrugt som rusmiddel. Når gassen indåndes, kan den give en kortvarig følelse af eufori og svimmelhed. Men misbrug er farligt: indånding af ren lattergas kan føre til iltmangel, og gentagen brug kan skade nervesystemet, fordi gassen nedbryder kroppens B12-vitamin. Derudover kan brugeren miste bevidstheden og komme ud for alvorlige ulykker.

Du kan læse her om en læge, der behandler misbrugere af lattergas. Der kan du også finde et link til DR-serien ’Livsfarlig lattergas’, som gennem tre afsnit undersøger, hvor udbredt misbruget er.
Du har fået forskellige oplysninger om dinitrogenoxid ovenfor. Nu skal du sammen med en makker prøve at se, hvor meget I til sammen kan huske og har forstået om molekylet. I må ikke kigge ovenfor.
1. Forklar, hvorfor molekylet kaldes dinitrogenoxid i kemi.
2. Hvorfor er dinitrogenoxid lineært, selvom der er tre atomer i molekylet?
Se mere
CFC-gasser er en samlet betegnelse for en række af gasser, som indeholder chlor, fluor og carbon. Gasserne er syntetiske og meget stabile og har haft en række fordelagtige egenskaber, men efter mange års brug, fandt man ud af, at de samme fordelagtige egenskaber var skyld i, at ozonlaget blev nedbrudt. En verdensomspændende aftale fik forbudt stofferne, og som du kan læse om under Fun Facts om ozonmolekylet, er ozonlaget godt på vej til at blive gendannet.
I opgave 12 dykker du ned i både strukturen og de fysiske og kemiske egenskaber for CFC-gasser.
På baggrund denne engelske tekst fra Imperial College London skal du forsøge at lave følgende opgaver.
1. Der er vist fire strukturer af forskellige CFC-molekyler. Sammenlign strukturen af disse med strukturen for de andre gasser i atmosfæren længere oppe og giv et bud på, om der er tale om en lineær, plan eller tetraederisk opbygning omkring carbonatomerne.
2. Beregn ΔEN for de enkelte bindinger i alle fire molekyler og kommenter herefter på, om molekylet overordnet er polært eller upolært. Her kan du finde information fra afsnittene om de andre gasser i atmosfæren, som kan hjælpe dig.
3. Den almindelige forbruger havde kontakt med CFC-gasser i mange sammenhænge, før de blev forbudt. Lav en liste over de nævnte anvendelser af CFC-gasser, som står i teksten.
4. Når du sveder, fordamper vandet fra din hud, og du bliver afkølet. Læg mærke til kogepunkterne for gasserne. Kan du gennemskue, hvorfor CFC-gasser med kogepunkt fx omkring 0°C, kan afkøle et køleskab?
5. Når CFC-gasserne når op i stratosfæren, nedbrydes de af UV-strålingen, og der dannes frie chloratomer, som du kan se i de første to reaktionsskemaer i teksten. Hvis du tænker på, hvor i det periodiske system, chloratomet befinder sig, kan du så forklare, hvorfor det er så reaktivt? Du kan med fordel inddrage ædelgasreglen.
6. Molekylet chlormonoxid har ligesom chloratomet en uparret elektron, og det gør begge meget reaktive. Forklar, hvorfor det er et problem for ozonlaget, at chlor gendannes i den 4. reaktion.
Se mere
Du har nu lært om atmosfærens gasser. Du har mødt de helt almindelige som dinitrogen og dioxygen, og de særlige drivhusgasser som carbondioxid, methan og dinitrogenoxid, der spiller en central rolle i klimaforandringer.
Men atmosfæren rummer mere end gasser. Den indeholder også partikler, som med et fagudtryk hedder aerosoler. De kan stamme både fra naturlige kilder som vulkanudbrud, havsprøjt og skovbrande og fra menneskelig aktivitet som biltrafik og industri. De er små faste stoffer eller væskedråber, som svæver i luften. Selv om aerosoler er bittesmå faste stoffer eller væskedråber, kan de have stor betydning for både helbred og klima, bl.a. fordi de fungerer som kim til skydannelse.
3 Partikler i atmosfæren
Aerosoler kan svæve i luften i dage til uger, og de findes overalt – fra byernes udstødningsgasser til støv, der transporteres over kontinenter. Måske har du hørt om fænomenet ’blodregn’, hvor rødligt støv fra Sahara føres helt til Danmark. Når det blandes med regndråber, kan det give en svagt rødlig regn, som du kan se i figur 32. Det giver også helt utroligt flotte solnedgange, fordi støvet bryder lyset. Det er et tydeligt eksempel på, hvordan partikler kan rejse enorme afstande og stadig påvirke vores miljø.

Aerosoler varierer meget i størrelse, form og kemisk sammensætning, og derfor også i deres virkning på klimaet. Nogle er naturlige, mens andre stammer fra menneskelig aktivitet. Naturlige kilder til aerosoler omfatter fx havsprøjt, der danner små saltkrystaller, vulkanudbrud, som sender svovlholdige partikler højt op i atmosfæren, og skovbrande, der frigiver sod og organiske stoffer. Menneskeskabte kilder inkluderer biltrafik, industri og afbrænding af fossile brændstoffer. De mindste partikler, især de såkaldte PM2.5 med en diameter på 2,5 µm eller mindre, er mest sundhedsskadelige, fordi de kan trænge dybt ned i lungerne og øge risikoen for luftvejssygdomme og hjerte-kar-sygdomme. I figur 33 kan du få en fornemmelse for størrelsen af aerosoler.
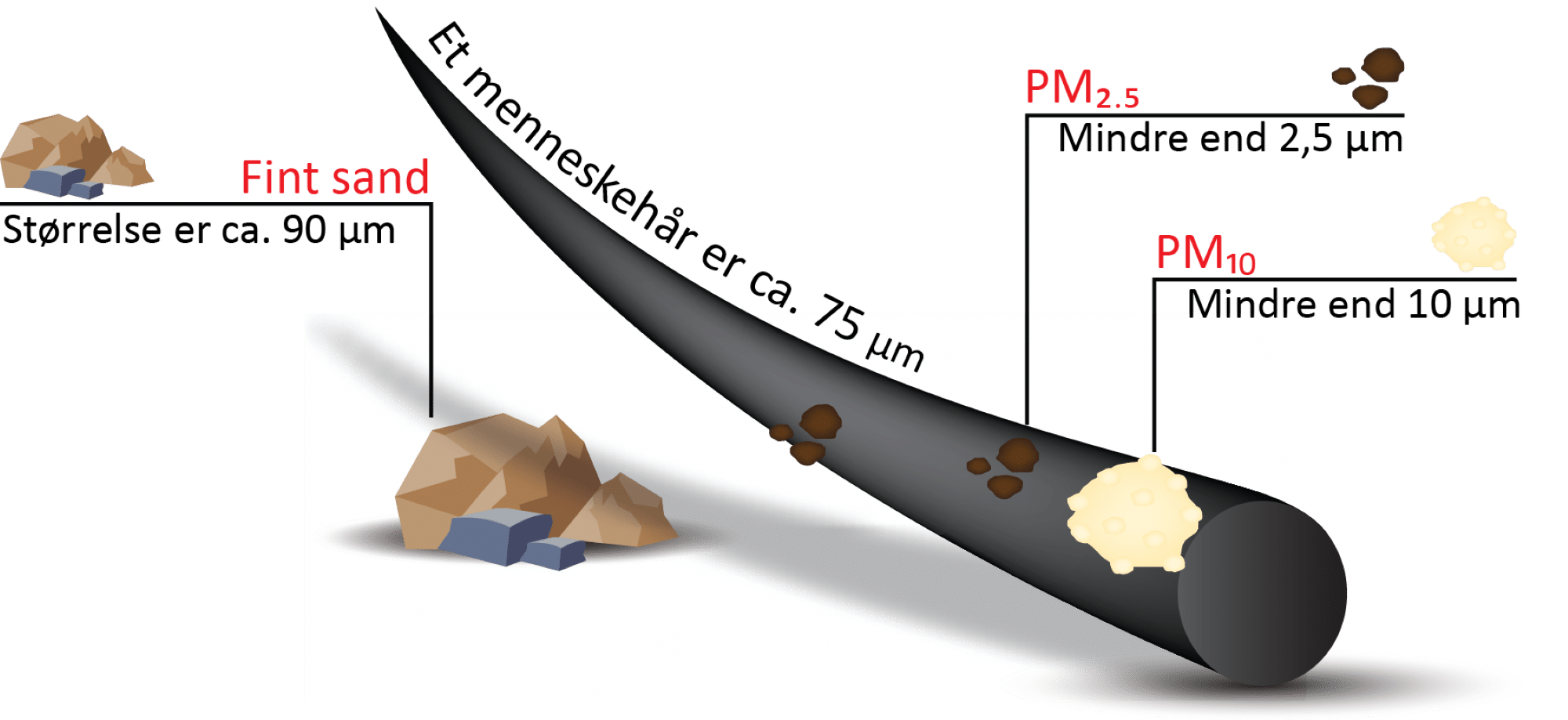
Aerosoler påvirker også klimaet på komplekse måder. Nogle partikler som sod absorberer sollys og varmer atmosfæren op, mens andre som sulfataerosoler reflekterer sollys og virker afkølende. Derudover spiller aerosoler en central rolle i skydannelse, fordi de fungerer som små overflader, som vanddamp kan kondensere på. Antallet, størrelsen og den kemiske sammensætning af partikler afgør, hvor let skyer dannes, hvor reflekterende de bliver, og hvor længe de lever. Derfor har selv meget små mængder aerosoler en stor betydning for vores klima.
For at forstå skydannelse og aerosolernes rolle i klimaet endnu bedre forsker danske kemikere i de helt grundlæggende processer, der sker på molekylært niveau. Det arbejde foregår blandt andet i Center for Chemistry of Clouds, som du kan læse om i faktaboksen herunder.
Forskning i skydannelse på molekylært niveau
’Mennesket har altid observeret skyer, men faktisk ved vi forbavsende lidt om, hvordan de dannes’, siger centerleder af Center for Chemistry of Clouds, (C3), Merete Bilde.

C3 er et grundforskningscenter på Institut for Kemi på Aarhus Universitet med fokus på skydannelse og kemien bag. Centeret er finansieret af Danmarks Grundforskningsfond. Om forskningen, siger Merete Bilde:
’Vi forsker i de helt grundlæggende molekylære byggesten til skydannelse.
Skyer dækker to tredjedele af himlen og påvirker i høj grad vores klima.
Derfor er det vigtigt at forstå skydannelse og skyers påvirkning af klimaet,
især for at kunne forudsige fremtidens klima.’
For at der kan dannes skyer, skal der være en overmætning af vand i atmosfæren og en overflade, som vandet kan kondensere på. Aerosoler er bittesmå partikler, der er til stede over alt, og netop er den overflade, vandet har brug for. Forskerne i C3 arbejder fra før aerosolerne er dannet til de kan blive skydannelseskerner. Merete fortæller:
’I vores laboratorium kan vi simulere dannelsen af aerosoler og måle
mange af de egenskaber, der er vigtige for, om de kan danne skyer.
Men hvis partiklerne er mindre end 2 nm,
har vi brug for kvantekemi for at undersøge,
hvordan de dannes fra gasfasemolekyler
og hvordan de vokser indtil de når en størrelse vi kan måle.’
I figur 34 kan du se en størrelsesskala for partikler, der kan vokse sig store og blive til skydannelseskerner. De allermindste byggesten til aerosoler er molekylære klynger, som består af nogle få molekyler, der holdes sammen af svage kemiske kræfter. De er større end enkeltmolekyler, men stadig for små til at blive betragtet som egentlige partikler.
Når partiklerne når over 2 nm, kan deres egenskaber undersøges i laboratoriet. Her vokser de enten ved kondensation af organiske oxidationsprodukter eller ved optag af vand, afhængigt af deres overflade og kemiske sammensætning.
Partikler omkring 50 nm kan begynde at fungere som skykondensationskerner, men det kræver, at de også har de rette kemiske egenskaber. Det er derfor ikke størrelsen alene, der afgør, om en partikel kan aktiveres som en skykondensationskerne, da både vandoptagelse og sammensætning spiller en vigtig rolle.
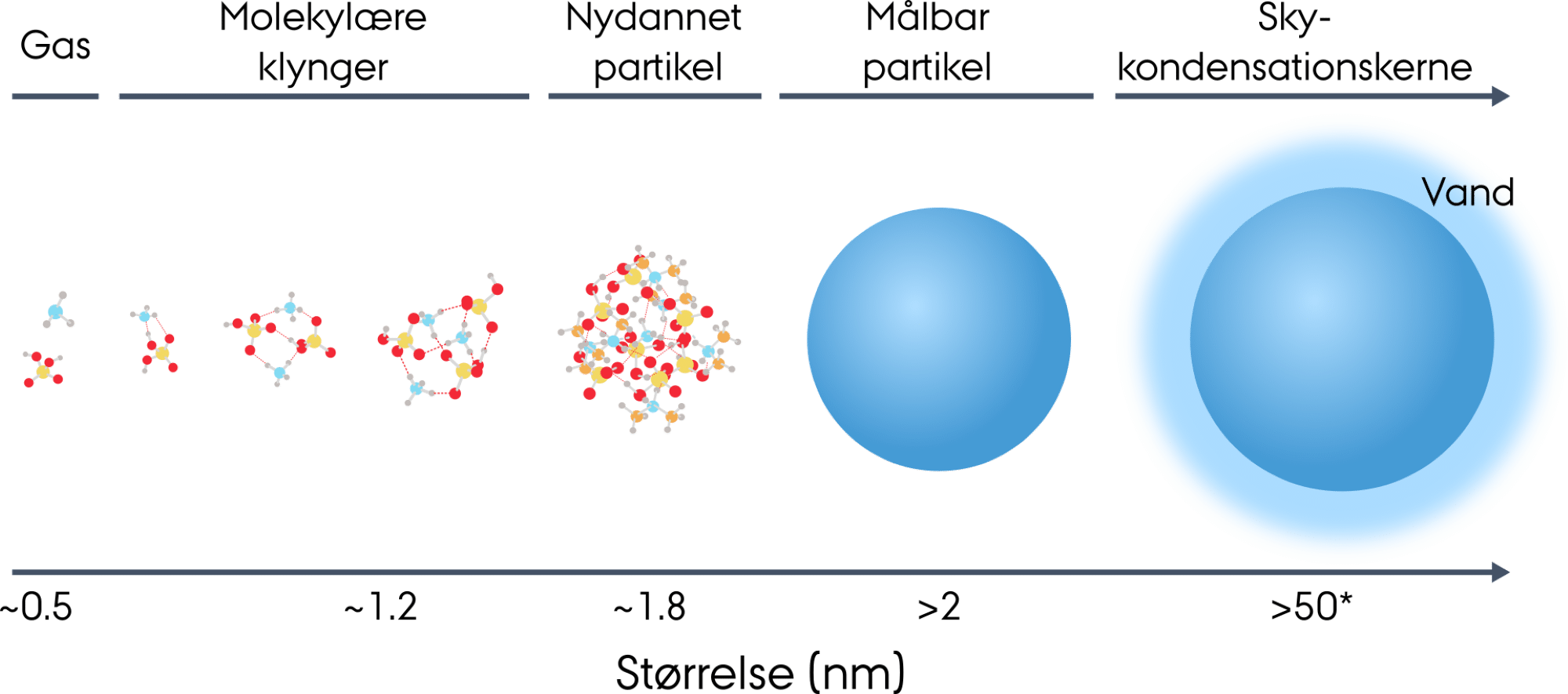
Derudover undersøger de aerosolernes overflade, og hvordan molekyler interagerer med overfladen og måske optages i aerosolpartiklerne. Overfladen betyder meget for om partiklerne kan optage vand og vokse sig store nok til at være en skykondensationskerne.
C3 består af seks forskere med hver deres ekspertiseområde:
1. Professor Merete Bilde er atmosfærisk fysisk kemiker. Hun forsker i aerosolers dannelse og egenskaber som fx deres viskositet, og hvor gode de er til at danne skyer.
2. Professor Ove Christiansen er kvantekemiker. Han bidrager med kvantekemisk metodeudvikling og brug af machine learning til at løse komplekse problemstillinger.
3. Lektor Marianne Glasius er analytisk miljøkemiker. Hun udvikler analysemetoder til at måle den kemiske sammensætning af aerosoler for at studere deres dannelse og kilder.
4. Lektor Tobias Weidner er laserkemiker. Han bidrager med at måle hvordan stoffer orienterer sig ved aerosolers overflade, hvilket kan have stor betydning for deres egenskaber i atmosfæren.
5. Lektor Jonas Elm er kvantekemiker. Han forsker i, hvordan man går fra gasfasemolekyler til molekylære klynger og helt nydannede partikler. Han arbejder i området, før man kan måle aerosolerne.
6. Adjunkt Fabian Mahrt er atmosfærisk fysisk kemiker. Han forsker i de kemiske og fysiske egenskaber af aerosoler, blandt andet hvordan aerosolpartikler med komponenter på forskellige tilstandsformer påvirker skydannelse.
Som du kan se, bidrager kemikere inden for vidt forskellige områder helt fra analytisk kemi og atmosfærisk fysisk kemi til kvantekemi og laserkemi til en samlet forståelse af, hvordan aerosoler dannes, vokser og påvirker skydannelse og klima.
Om C3s overordnede mål med forskningen siger Merete Bilde:
’Vi håber på at kunne bidrage med vigtig viden om aerosolers
dannelse, vækst, vandoptag og tilstandsformer.
Det er alt sammen viden, der kan forbedre klimamodeller
og dermed vores muligheder for at forudsige fremtidens klima’.
Se mere
Forskningen i C3 giver vigtig indsigt i de allerførste byggesten til aerosoler og skydannelse fra molekylære klynger til partikler, der vokser sig store nok til at blive skykondensationskerner. Men selvom forskerne kan undersøge de helt små molekylære processer, kræver det også, at man kan genskabe atmosfæren i større skala for at forstå, hvordan skyer faktisk dannes. Derfor arbejder atmosfærekemikere også med simulationskamre som AURA, hvor temperatur, fugtighed og lys kan styres præcist for at efterligne forholdene i atmosfæren.
Inden du læser videre om AURA, skal du prøve noget af det mest grundlæggende inden for skydannelse. Du skal lave din egen sky i en flaske! I ’Forsøg 1: Flaskeskyen’ får du mulighed for at se, hvordan vanddamp, tryk og en smule aerosoler tilsammen kan få små dråber til at kondensere præcis som det sker i atmosfæren. Forsøget giver dig en hands-on forståelse for nogle af de samme processer, som forskerne i C3 og AURA arbejder med på et langt mere avanceret niveau.

Lav din egen sky! Når der er en overmætning af vand og en overflade, vandet kan kondensere på, kan du lave en sky.
Øvelsesvejledningen er på vej.
4 Atmosfærens betydning for klimaet
Carbondioxiden i atmosfæren er blot en af flere gasser i atmosfæren, og det er en af dem, der er meget lidt af.
1. Hvis du sammenligner koncentrationen af carbondioxid i figur 1 og 11, er de to tal forskellige. Prøv at finde information i figurerne, figurteksterne og teksten omkring figurerne for at finde en forklaring på dette.
2. Brug dette link til at undersøge variationen af CO₂-koncentrationen over tid. Hvad kan du sige helt generelt?
3. Er CO₂-koncentrationen i figur 1 angivet korrekt, hvis du kigger på linket? Hvad kan du aflæse den til?
4. Prøv at give et bud på, hvad forklaringen kan være.
Se mere
Der er desværre ingen tvivl om, at CO₂-koncentrationen i atmosfæren stiger, og at det skyldes os mennesker. Men før du kan læse om, hvorfor det resulterer i drivhuseffekten og øger den globale opvarmning, skal du vide, hvor carbondioxiden i atmosfæren kommer fra. Og den kommer både af naturlige årsager og som resultat af menneskelig aktivitet.
Du skal starte med at se en kort film. Den forklarer, hvorfor carbondioxid er en ressource, som danner grundlaget for alt liv, og som vi derfor ikke kan undvære. Se filmen her.
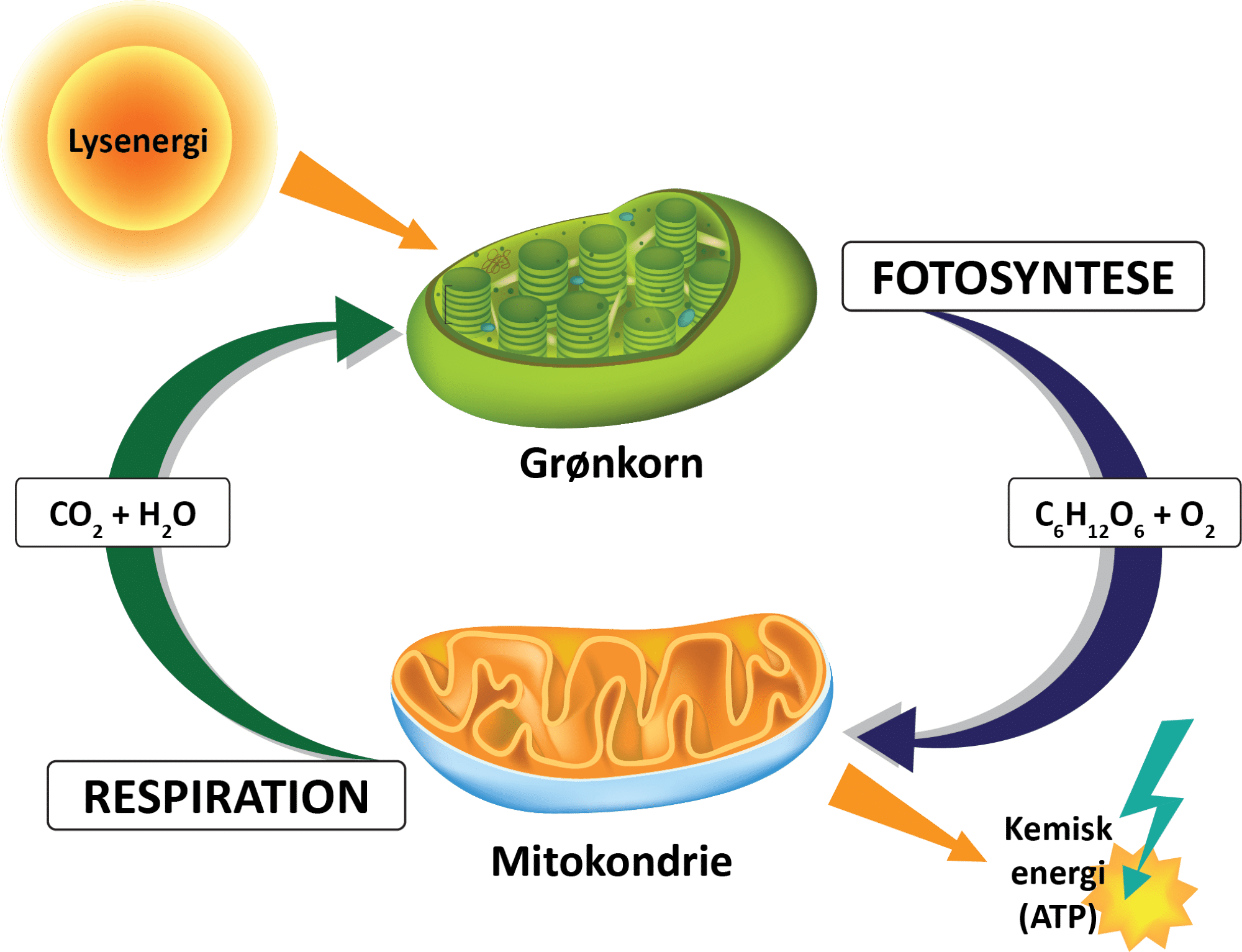
I fotosyntesen, som sker i planternes grønkorn (se figur 32), sker følgende reaktion:
6 CO2(g) + 6 H2O(l) → C6H12O6(aq) + 6 O2(aq)
(5)
Her lagres energi fra solens stråler i organiske forbindelser, der alle stammer fra carbondioxid i atmosfæren. Når de organiske forbindelser nedbrydes igen i cellernes mitokondrier (se figur 32), sker respirationsreaktionen:
C6H12O6(aq) + 6 O2(aq) → 6 CO2(aq) + 6 H2O(l)
(6)
Kig grundigt på reaktion (5) og (6). Kan du gennemskue sammenhængen mellem de to reaktioner og argumentere for, at der er tale om cirkulær kemi? Du kan inddrage figur 32 i din argumentation.
Se mere
I faktaboksen, ’Redox i din hverdag’, kan du læse mere om fotosyntesen og respirationen, som er eksempler på redoxreaktioner.
Systemet bestående af fotosyntesen og respirationen i figur 32 er altså en naturlig cyklus, hvor carbondioxid omdannes til organiske stoffer og frigives igen til luften, når de organiske stoffer forbrændes som mad i vores maver eller når de nedbrydes af fx bakterier og svampe. Du kan se en kort, opsummerende film om denne del af den naturlige udledning af carbondioxid. Systemet er en del af kulstofkredsløbet, som du kan læse mere om senere.
Der er andre naturlige processer, hvor carbondioxid frigives til atmosfæren. Vulkanudbrud er et eksempel herpå, der udleder enorme mængder af carbondioxid og andre gasser som fx svovldioxid. Også naturbrande udleder carbondioxid lige så vel som vådområder, hvor en langsom forrådnelse af gamle træer og andre organiske materialer sker. Her udledes desuden også større mængder af drivhusgassen, methan. I havet er der også bundet en del carbondioxid, men opløseligheden af gassen i vand falder, jo varmere der bliver.
Og så nærmer vi os den menneskelige indflydelse på koncentrationen af carbondioxid i atmosfæren. For med global opvarmning pga. drivhuseffekten (se faktaboksen, ’Drivhuseffekten resulterer i global opvarmning’ nedenfor) stiger temperaturen i havet, og der frigives carbondioxid. Opvarmningen resulterer også i, at store områder, hvor der naturligt har været permafrost (dvs. jorden frossen hele året), tør, og så sker der en enorm omsætning af dødt, organisk materiale. Dette forårsager også en stor udledning af carbondioxid og methan. Så menneskelig aktivitet påvirker klodens temperatur og speeder de naturlige processer yderligere op.
I fotosyntesen omdannes solens energi til kemisk energi, som lagres i molekylet ATP (adenosintriphosphat) og i andre organiske forbindelser. I denne proces bruges atmosfærens carbondioxid (se figur 32), men så snart det organiske materiale forbrændes, frigives carbondioxiden igen sammen med energien.
Nu skal du selv på arbejde! Du skal i opgave 15 undersøge forskellige eksempler på menneskeskabt CO₂-udledning.
Du skal vælge mindst to af nedenstående eksempler på menneskeskabt udledning af carbondioxid. Du skal søge baggrundsinformation på nettet om eksemplerne og finde mindst 3 eksempler på kemiske reaktioner, der viser, at der udledes CO₂.
a. Forbrænding af fossile brændstoffer
b. Industriproduktion som fx cementfremstilling
c. Skovrydning
d. Landbrug som fx dræning af vådområder eller fremstilling/brug af kunstgødning
e. Affaldsforbrænding
Skriv til sidst en halv side om menneskeskabt udledning af carbondioxid, som kunne indsættes efter denne opgave og udgøre en del af dette undervisningsmateriale.
Se mere
Umiddelbart kunne det lyde som om, der ikke sker en stigning i CO₂-koncentrationen, da den CO₂, der bruges i fotosyntesen, frigives igen i alle de mange processer og eksempler ovenfor. Men så simpelt er det ikke, for der er en faktor mere, som du skal tage i betragtning, og det er tid! Hvor lang tid tager det fx at danne fossile brændstoffer i forhold til hvor hurtigt, det kan brændes af? Først skal du afprøve, hvor hurtigt, du kan afbrænde lightergas, som er et eksempel på et organisk materiale, der stammer fra fossile brændstoffer. Det gør du i ’Forsøg 2: Gaskanonen’. Bagefter kan du læse mere om bl.a. dannelsen af fossile brændstoffer i næste afsnit om kulstofkredsløbet.
Du skal bygge en gaskanon. Se hvor hurtigt, man kan afbrænde fossile brændstoffer og se, at der kommer energi ud af det.
Se øvelsesvejledningen her.
Kulstofkredsløbet er et kredsløb, der beskriver, hvordan carbon cirkulerer rundt gennem forskellige kulstofforbindelser på vores planet. Det kan blive meget komplekst at forstå alle dele af det, så i stedet for møder du en forenklet udgave, da du kun skal have et overblik over det.
Hvis du ikke har set den korte film om den naturlige udledning af carbondioxid, er det en god ide at se den, før du dykker ned i kulstofkredsløbet. Du kan se filmen her.
For at forskere kan arbejde på at finde metoder til at fjerne carbondioxid fra atmosfæren, er de nødt til at forstå kulstofkredsløbet, som du kan se en oversigt over i figur 33. Øverst i figuren er carbondioxidmolekyler i atmosfæren vist. Disse fanges og bindes i organiske forbindelser gennem planternes fotosyntese. Gennem planters og dyrs respiration af de organiske stoffer frigives carbondioxiden igen (se figur 32 og 33):
Organisk stof + O2(g) → CO2(g) + H2O(l) + energi
(7)
Energien fra respirationen kan enten være en omdannelse af kemisk energi i det organiske stof til ren varmeenergi eller til en blanding af kemisk energi i andre kemiske forbindelser og varmeenergi.
Carbondioxid er opløseligt i vand, så der vil altid være opløst carbondioxid i havet og i søer. Her reagerer det med vand og danner forbindelsen hydrogencarbonat (HCO3–), som vandplanter (alger og planteplankton) optager og bruger i deres fotosyntese. Når vandplanterne respirerer, udskiller de også CO₂. Når planteplankton spises af muslinger, der filtrerer vandet, og disse spises af fx krabber, vokser dyrene i størrelse og indeholder dermed mere kulstof. Når dyr og planter dør, vil bakterier og andre nedbrydere respirere og omdanne kulstoffet til carbondioxid. Dette kræver, at der er dioxygen til stede, og er der ikke nok af dette, vil det døde, organiske materiale samle sig og med tiden synke ned i undergrunden, hvor det under højt tryk og temperatur kan omdannes til de fossile brændstoffer gas, kul og olie.
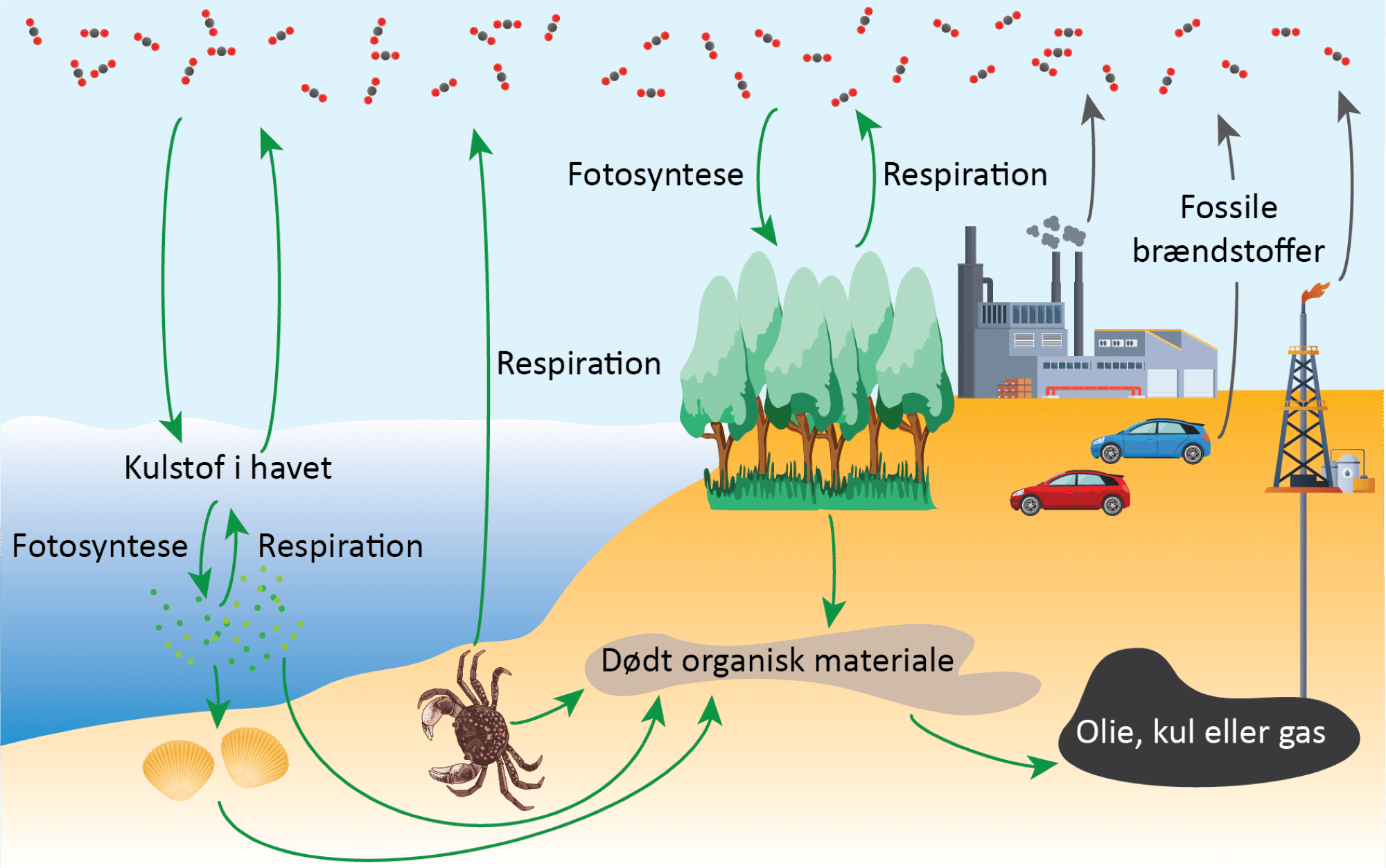
Fotosyntesen og respirationen er to relativt hurtige processer, hvor fx nogle af de ældre træer i Danmark som bøg og eg kan blive hhv. 300 og 1000 år gamle, mens græs vokser hen over sommeren. Når du klipper græsset, nedbrydes det afklippede græs temmelig hurtigt og forsvinder ofte inden du klipper det næste gang, mens et dødt egetræ tager mange år om at blive nedbrudt til CO₂. Nok kan 100 år virke som lang tid, men det er ingenting sammenlignet med omdannelsen til fossile brændstoffer, der tager millioner af år. Omvendt tager det ikke lang tid at udgrave kul eller pumpe olie og gas op fra undergrunden og brænde det af. Du kan se denne korte video om dannelsen af kul, og denne video om dannelsen af olie.
Du skal nu prøve at regne på omdannelsen af dieselolie til carbondioxid og vand.
Et eksempel på en organisk forbindelse i dieselolie kunne være C12H24. Når den afbrændes, sker følgende reaktion:
| C12H24 + O2 → CO2 + H2O | (8) |
a. Først skal du give et bud på tilstandsformer for alle stofferne. Herefter må du gerne prøve at undersøge det nærmere på nettet. Hint: Hvordan vil du normalt beskrive olie?
b. Afstem reaktionsskemaet.
c. Hvis du afbrænder 1 kg dieselolie, hvor meget carbondioxid producerer du?
Se mere
Flybrændstof består af en blanding af mange organiske stoffer baseret på fossile brændstoffer. Der vil derfor være mange forskellige reaktionsskemaer og ikke kun ét som i opgave 5, og derfor er det svært at lave en nøjagtig beregning på, hvor meget CO₂, du ville udlede, hvis du fx fløj fra Europa til Nordamerika. Men der er alligevel lavet forskellige overslag på det. Her er der lavet en sammenligning af to forskellige flytyper, hvor man beregner udledningen af CO₂ per person og bagefter estimerer, hvor meget ekstra der kommer oveni, når man også tager i betragtning, at olien skal pumpes op fra jorden, den skal transporteres, den skal forbi et olieraffinaderi og omdannes, flyet skal produceres og vedligeholdes, piloter og folk i lufthavnen skal ansættes, lufthavnen skal bygges, vedligeholdes, opvarmes osv.
a. Læs beregning nr. 1 (”Basis 1 for calculation”). Du må gerne bruge google translate.
b. Hvor meget CO₂ udleder de to typer af fly i timen per passager?
c. Hvad bliver den samlede CO₂-udledning per passager per time, når alt tages med i betragtning?
d. Kan du gennemskue, om der er nogle usikkerheder i antagelserne, der ligger til grund for beregningerne?
Se mere
ChatGPTs strømforbrug, vedligehold og drift af servere og nedkøling resulterer i en CO₂-udledning per måned, der svarer til 260 transatlantiske flyvninger, når man ikke medregner de ekstra udgifter med at pumpe olien op m.m.?
Den enkelte søgning på ChatGPT giver en CO₂-udledning på 1,59 g per side, men fordi der er virkelig mange mennesker, der bruger platformen, resulterer det i så høj CO₂-udledning. Det skyldes blandt andet, at der skal bruges strøm til at holde de store datacentre i gang, der gemmer og behandler billeder, videoer og beskeder. Og de skal også køles ned. Men der er faktisk andre velkendte platforme, der af samme årsager har en høj CO₂-udledning, som du kan se i figur 34.
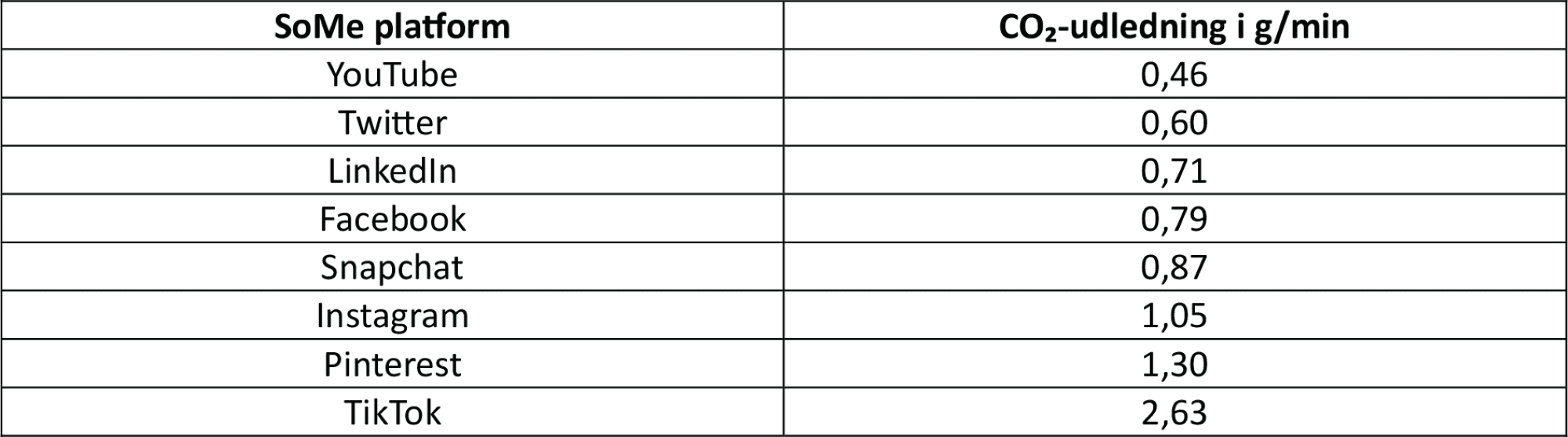
Diskutér i grupper, hvor meget tid I bruger på de forskellige sociale medier per dag, og lav et overslag over, hvor meget CO₂ I tilsammen har udledt den seneste uge.
Se mere
Det er rigtig godt, at du og andre bliver bevidste om jeres påvirkning af klimaet. Klimaaftrykket fra dit individuelle SoMe-forbrug er relativt lille sammenlignet med udledning af carbondioxid fra transportsektoren, tøjforbrug og fødevareproduktion. Herudover er der heldigvis mange tech-virksomheder, der investerer i vedvarende energi og energieffektive datacentre.
Nu ved du mere om, hvor carbondioxiden i atmosfæren kommer fra, og at en del skyldes menneskelige aktiviteter. Men hvad er problemet med, at koncentrationen stiger? Det kan du læse mere om i faktaboksen ’Drivhuseffekten’.
Drivhuseffekten resulterer i global opvarmning
Solens stråler består af en blanding af alle de farver af lys, som du kan se, og også ultraviolet lys, røntgenstråler, gammastråler, infrarøde stråler, mikrobølger og radiobølger (se figur 35), der tilsammen udgør det elektromagnetiske spektrum.
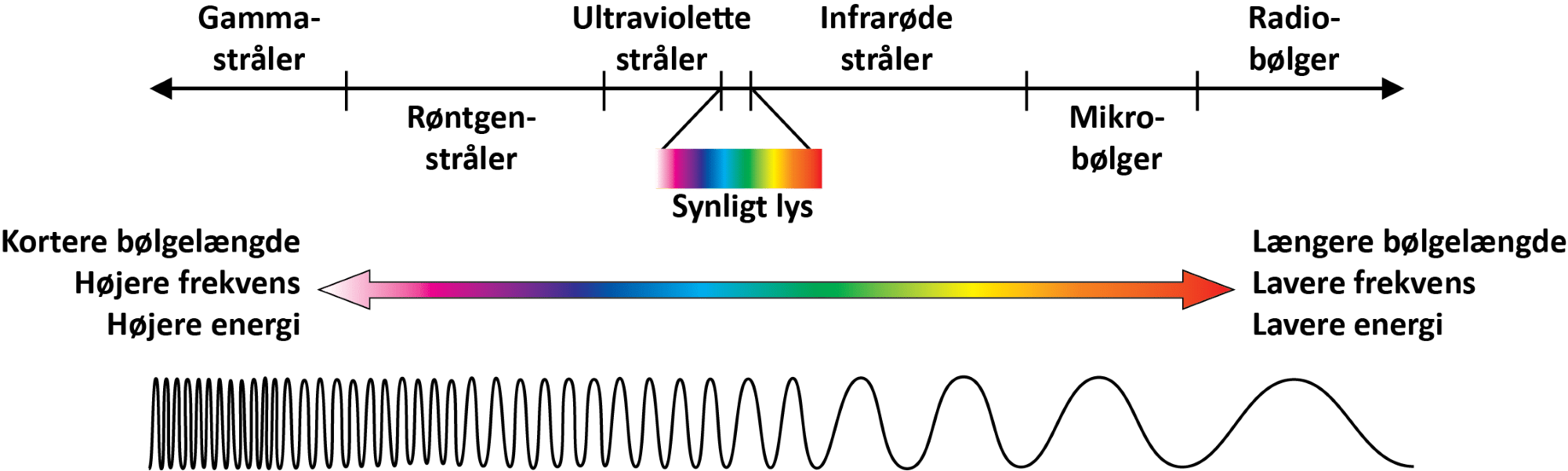
Du kan lære meget mere om bølger i fysik, men også kemikere gør brug af næsten hele det elektromagnetiske spektrum, som er vist i figur 35, til at undersøge molekyler. For at forstå drivhuseffekten er det tilstrækkeligt at vide, at jo større bølgelængden er (afstanden fra bølgetop til bølgetop), jo lavere energi har strålingen.
Når solens stråler rammer jordens atmosfære og især skyerne, vil en del af dem reflekteres og stråle tilbage ud i rummet (se figur 36). Hvis de rammer lyse områder på jordens overflade som fx sne og is, reflekteres sollyset også. Dette kaldes for albedoeffekten. Albedo er et mål for, hvor meget en overflade kan reflektere lys og dermed også den tilhørende energi. Forskellen mellem hvor varmt, det er at have en hvid eller sort t-shirt på i solen en varm sommerdag, kender du sikkert allerede. Dette skyldes albedoeffekten. Du kan se mere om albedoeffekten her.
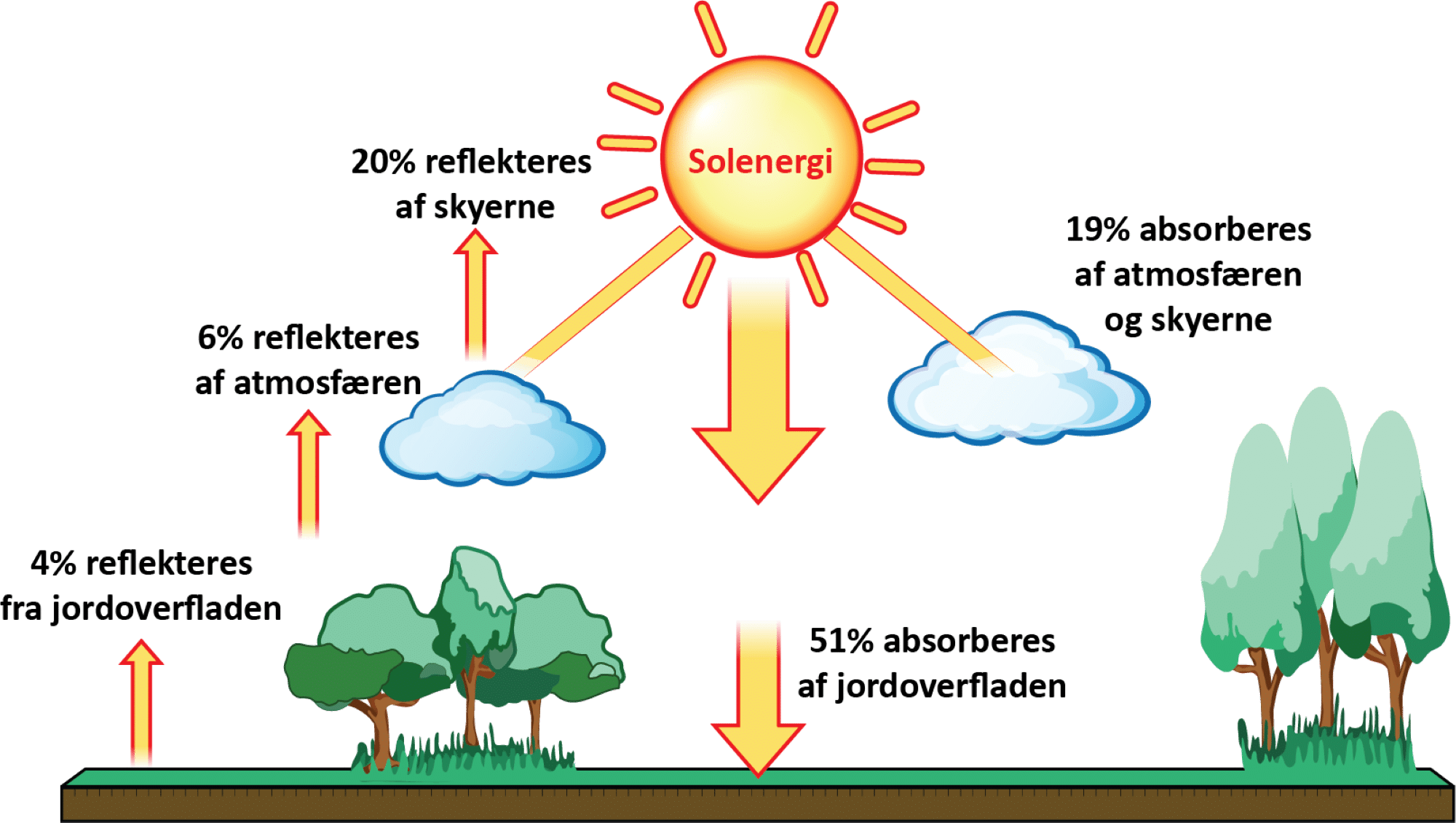
Det er især de kortbølgede, energirige stråler fra solen, der trænger igennem atmosfæren og rammer jordens overflade. Afhængigt af farven på den overflade, som strålerne rammer, som altså styres af albedoeffekten, bliver overfladen mere eller mindre varm. Der overføres altså energi fra de kortbølgede stråler til jordens overflade, som omdannes til varmeenergi, der har en længere bølgelængde. Herefter udsender overfladen varmestråling tilbage mod rummet, og den er i det infrarøde område, og dermed har strålingen lavere energi, og bølgelængden er større (se figur 35 ovenfor).
Den langbølgede varmestråling har en bølgelængde, der passer præcist til, at nogle af atmosfærens gasser absorberer den. Disse gasser er drivhusgasserne, som er vist i figur 37, og de fleste af disse forekommer naturligt i atmosfæren. Drivhusgasserne sender herefter nogle af strålerne ud i rummet og andre tilbage mod jordoverfladen. Det er faktisk ret heldigt, for uden drivhusgasser ville jordens overfladetemperatur være ca. -19°C, mens den nu er ca. 15°C.
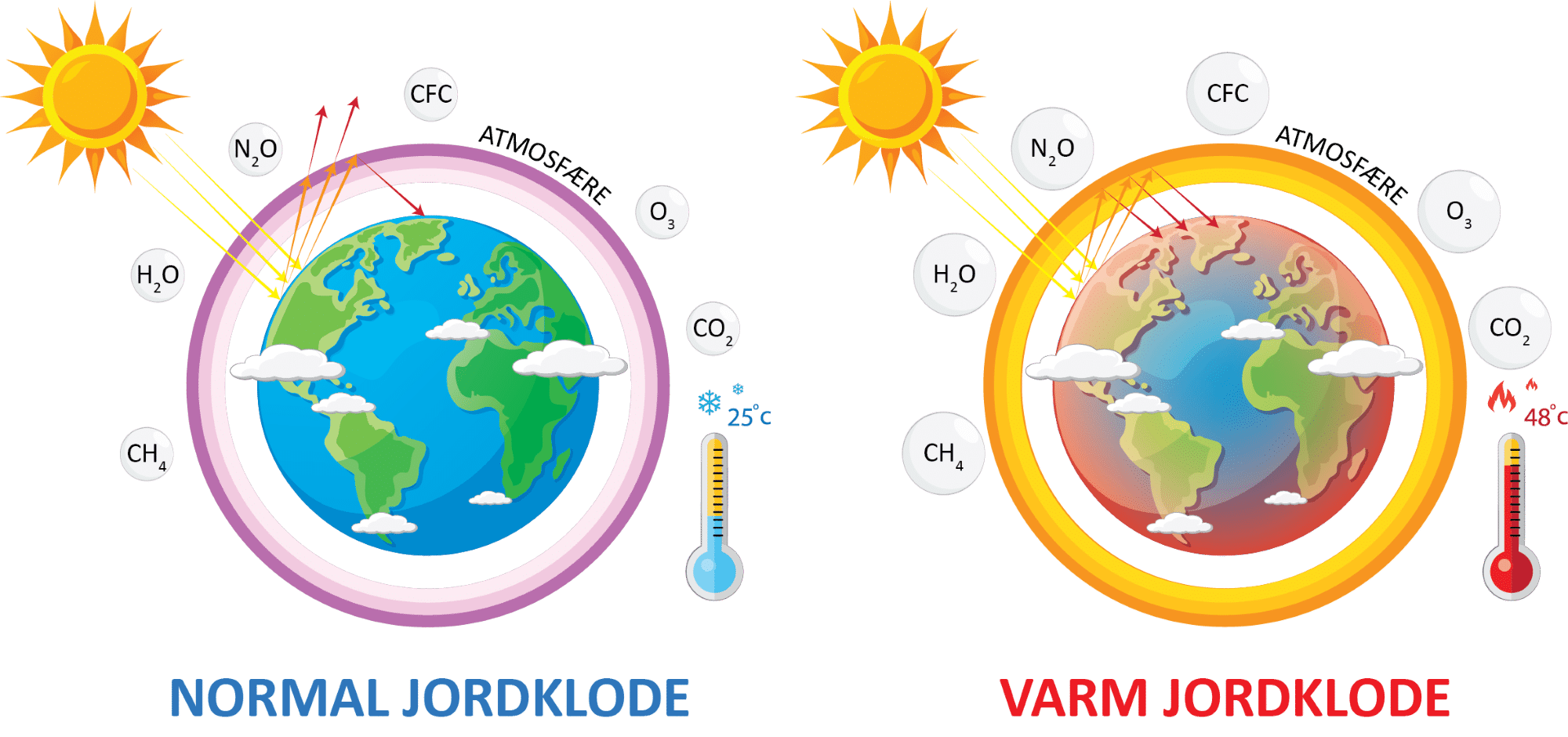
Men nu opstår problemet. Jo højere koncentrationen af drivhusgasser er, jo sværere er det for varmestrålingen fra jordoverfladen at passere forbi og videre ud i rummet. Og som du måske lagde mærke til i opgave 4, så er koncentrationen af drivhusgassen carbondioxid i atmosfæren stigende, og dermed er jordens gennemsnitstemperatur også stigende. Vi er godt i gang med den globale opvarmning. Du kan her se en kort video, der opsummerer drivhuseffekten og konsekvensen heraf.
Se mere
Når du hører om klimaet både i dette tema og i andre sammenhænge, støder du ofte på forskellige klimabegreber. I figur 38 kan du se en alfabetisk oversigt over de mest almindelige klimabegreber.
