1. Redoxreaktioner danner grundlaget for liv
Du har måske læst om redoxkemi i ’Fremtidens batterier – C-niveau’, men redoxkemi er vigtig i mange andre sammenhænge end batterier. Derfor er fokus i gennemgangen af kernestoffet i dette tema ikke kun på batterier, men vi vender tilbage til kemien i batterier i slutningen af temaet og i det sidste forsøg. Her kan du også læse om den spændende kemiforskning indenfor faststofbatterier.
Lad os starte med kigge på dig! Redoxreaktioner er helt essentielle for liv, og uden dem ville hverken du, bakterier eller andre levende organismer findes. Helt grundlæggende for alt liv er de to kemiske reaktioner – fotosyntesen og respirationen.
Når du spiser og trækker vejret, starter kroppens redoxreaktioner
I fotosyntesen vist i reaktion (1) dannes det organiske molekyle, glukose (C6H12O6), ud fra uorganiske stoffer, og lidt af energien fra solen lagres i de kemiske bindinger (se figur 1). Energien lagres i molekyler, lidt som energi lagres i et batteri. Glukose danner energigrundlaget for alt liv.
| 6 CO2(g) + 6 H2O(l) → C6H12O6(aq) + 6 O2(aq) | (1) |
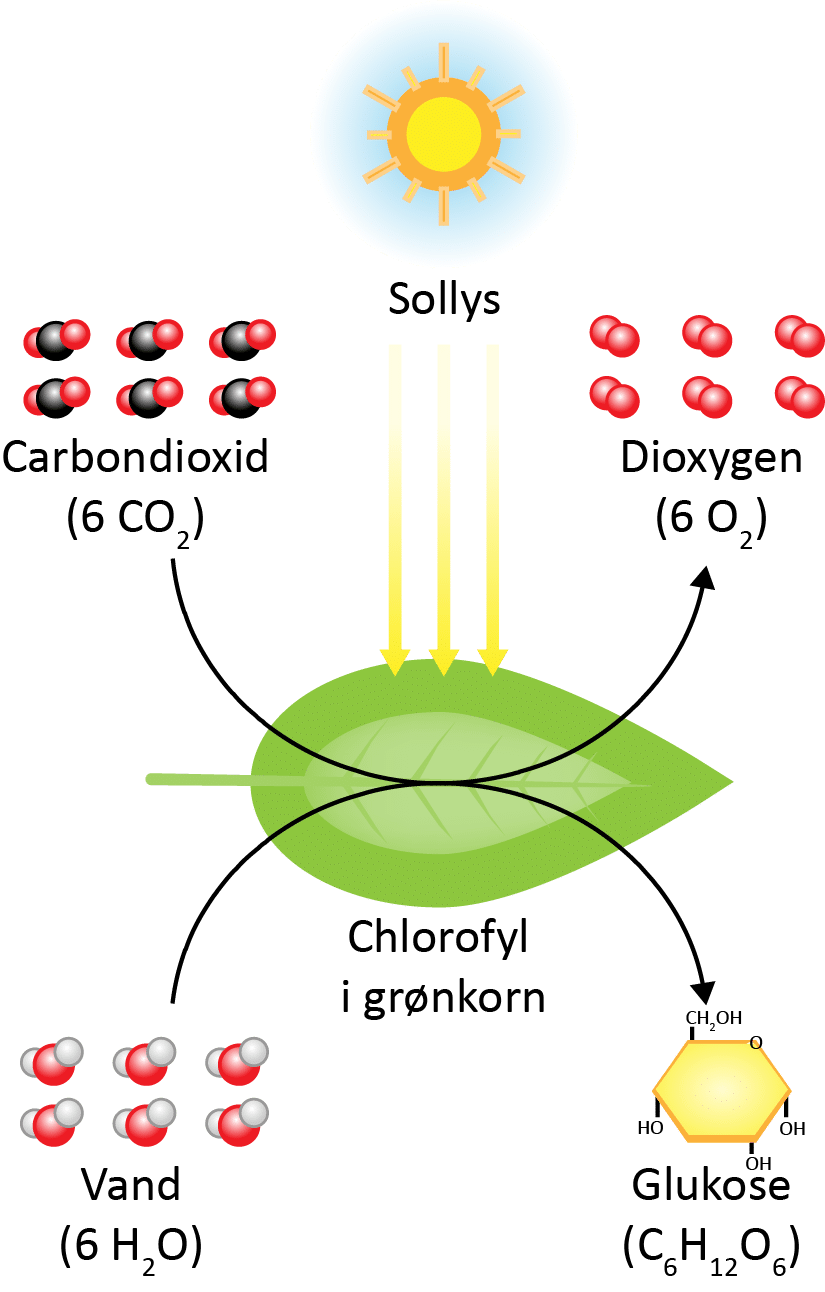
Nu kan der desværre ikke ske fotosyntese i dig, da det kræver nogle helt bestemte bestanddele i cellerne, der hedder grønkorn eller chloroplastre, som du ikke har. Smart havde det dog været, for så kunne du omdanne solens energi til næring. Fotosyntesen sker derimod i planter, der netop har grønkorn i mange af deres celler. I grønkornene sker en lang række af kemiske reaktioner, som typisk vil blive kaldt biokemiske reaktioner, fordi de sker i en levende organisme. Når man samler alle de kemiske reaktioner i fotosyntesen, ender man med reaktionen ovenfor (1). Planterne bruger herefter glukosen som byggesten til alle de andre organiske stoffer, de består af. Det er stoffer som kulhydrater, fedtstoffer, proteiner, DNA og RNA.

Når du spiser, får du energi ud af det, uanset om du spiser kød eller planter. Hvis du spiser en skive rugbrød (se figur 2), stammer størstedelen af indholdet direkte fra planter. Det gælder sigtet rugmel, rugkerne, fuldkornsrugmel, solsikkekerner, hørfrø, bygmaltekstrakt, eddike, rapsolie, sirup og enzymer fra hvede. Den energi, du får ud af at spise rugbrødet, stammer fra fotosyntesereaktionen.
Hvis du spiser et stykke kylling, er den energi, du får fra det, faktisk også dannet ud fra fotosyntesen. Kyllingens kød er dannet ud fra det organiske materiale, den spiser, og det er netop planter (se figur 3). Dog går der en del energi tabt fra plante til kylling og videre til dig. Energien forsvinder bl.a. som varmeenergi.

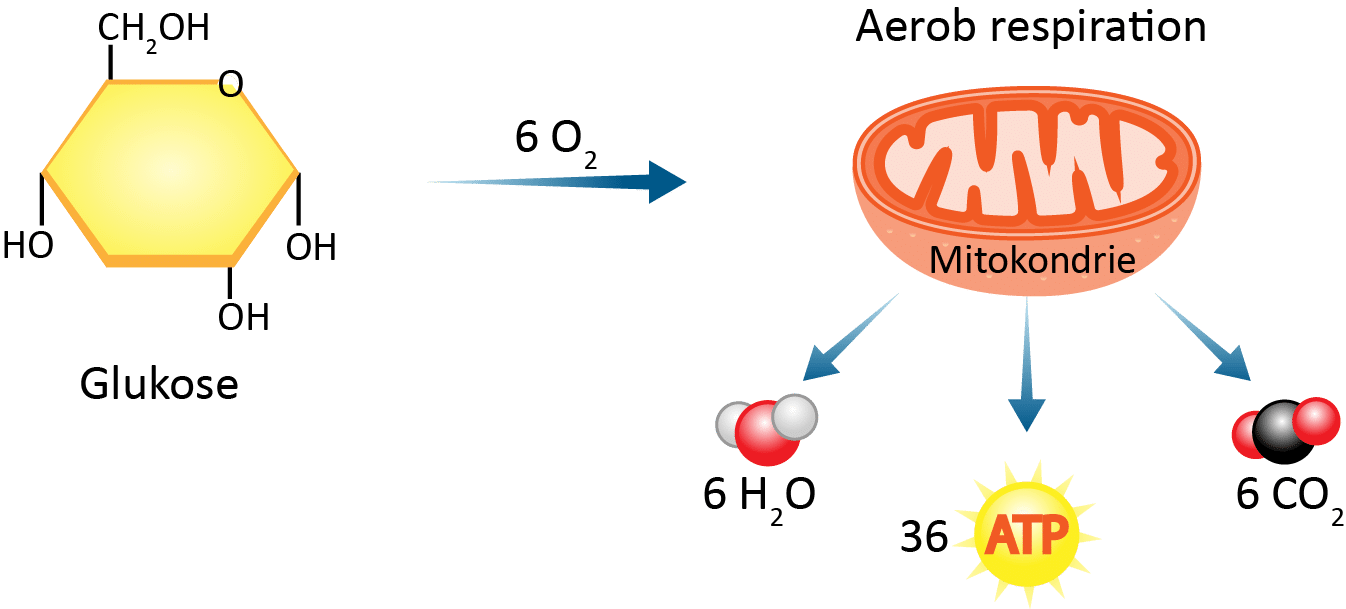
Når du spiser, nedbryder du maden til mindre bestanddele (fedtstoffer, kulhydrater og proteiner), og det, som kroppen kan bruge, beholder den, mens den skiller sig af med resten. Nedbrydningen af madens indhold af fedtstoffer, kulhydrater og proteiner kaldes også forbrænding, og alle forbrændingsreaktioner er redoxreaktioner. Den vigtigste forbrændingsreaktion i dyr og planter hedder respirationen, og den er præcis den omvendte reaktion af fotosyntesen. Her nedbrydes glukose vha. den dioxygen, vi indånder, til carbondioxid og vand.
| C6H12O6(aq) + 6 O2(aq) → 6 CO2(g) + 6 H2O(l) | (2) |
Respirationen foregår både i dyr og i planter i cellernes energifabrikker, kaldet mitokondrier (se figur 4). Reaktion (2) er en samlet reaktion for en lang række reaktioner, hvor der dannes mellemprodukter, og i løbet af disse reaktioner flyttes energien fra bindingerne i glukose til kemiske bindinger i et molekyle, der hedder ATP (adenintriphosphat). ATP-molekylet anvendes i din krop hele tiden – både mens du læser det her, hvis du bevæger dig, og mens du sover.
Kemi hænger sammen med både biologi og fysik, og måske har du opdaget, at vi ovenfor har bevæget os rundt i biologiens verden, og nu bevæger vi os faktisk også lidt ind i fysikkens verden. I fysik arbejder man også med energi, energibevarelse, energityper og hvordan en type omdannes til en anden. I fotosyntesen omdannes lysenergi til kemisk energi, som opbevares i bindingerne i glukose. I respirationen flyttes denne kemiske energi fra glukose til ATP, men undervejs omdannes noget af den kemiske energi til varmeenergi. Selvom man ofte siger, at man taber noget energi som varme, er der faktisk kun tale om en energiomdannelse, og energien er ikke tabt. Der er altså energibevarelse, som er en af de fundamentale love indenfor fysik.
I biologiens verden arbejder man også med energi og energibevarelse (se figur 3). Som tommelfingerregel siger man, at kun ca. 10% af energien går videre fra et led til det næste i en fødekæde. Resten tabes enten som energi bundet i affaldsstoffer eller som varmeenergi.
Se mere
I faktaboksen kan du se reaktionsskemaet for fotosyntesen og respirationen. Der står, at begge reaktioner er redoxreaktioner. Kan du argumentere for den påstand?
Se mere
Der sker selvfølgelig mange andre redoxreaktioner omkring dig end fotosyntesen og respirationen. Når hår afbleges, når maden mugner, når jern ruster, når du tænder et bål, eller når diesel- og benzinbiler har motoren tændt, sker der redoxreaktioner. Også i energisektoren, hvor man arbejder på at omstille mest mulig til grøn energi, bruges redoxreaktioner. I ‘Fremtidens batterier – C-niveau‘ lærer du den grundlæggende redoxkemi, som dette tema bygger ovenpå, og i ’Power-to-X og katalyse’ møder du også redoxreaktioner.
2. Skal alle skifte til elbil?
Har din familie selv en elbil, eller kender du selv en, der har en elbil? Har du nogen sinde overvejet, om de mon er så miljøvenlige, som producenterne af elbilerne og ejerne af elbilerne siger? Er der måske noget, der ikke fortælles? Det må undersøges!
I grupper på 2-4 elever skal I downloade eller printe skemaet til denne opgave (link).
a. Elbilen har et ømt punkt: Børnearbejde i koboltminer
b. Er elbiler klimavenlige? Vi gennemgår påstandene
Se mere
Du har måske opdaget, at det ikke er helt let at svare på spørgsmålet i opgaven. En faktor, der fx også spiller en rolle, før man kan tage stilling til spørgsmålet, er, hvordan du skal bruge bilen. Skal bilens batteri holde længe, eller skal det være meget effektivt? Nedenfor kan du lære mere om, hvor godt et genopladeligt batteri holder ift. et engangsbatteri.
Typisk vil et 1,5 V engangsbatteri kunne levere en spænding på 1,5 V fra starten, mens et tilsvarende genopladeligt batteri kan levere et sted mellem 1,2 og 1,3 V, som du kan se i figur 5. Dvs. engangsbatteriet er meget effektivt og kan få en lommelygte til at lyse meget kraftigt helt i starten. Efterhånden som batteriet bliver brugt, dvs. den resterende kapacitet falder, falder spændingen også, og lommelygten lyser hurtigt mindre og mindre. Et genopladeligt batteri kan derimod ikke levere en fuld spænding fra starten, men det vil kunne holde spændingen og dermed også lommelygtens lysstyrke meget mere stabilt, selvom kapaciteten falder. Har du derfor et apparat, som bruger meget lidt strøm, men skal være tændt længe, holder engangsbatterier bedre, men har du et apparat, som bruger meget strøm på kort tid, som fx din mobiltelefon, så holder genopladelige batterier bedre.
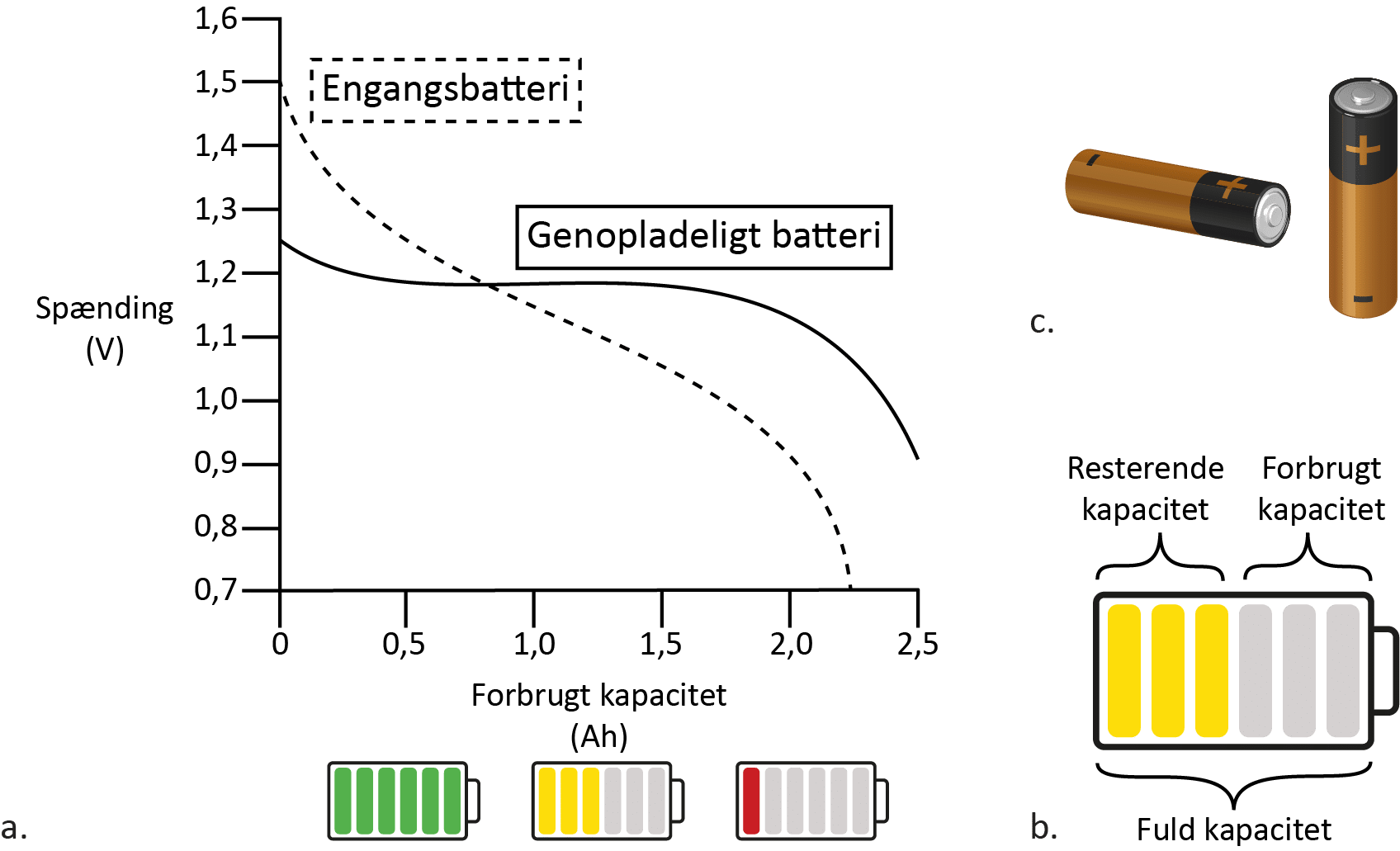
Hvis du kigger på den økonomiske side, vil det være billigere for forbrugeren – altså dig – at købe genopladelige batterier frem for engangsbatterier. Og kigger du på miljøhensyn, så skal der produceres og transporteres færre batterier fra fabrikker til butikker og videre til dig, hvis du køber genopladelige batterier. Oplades batterierne med grøn strøm fra vind- og solenergi, øger det bæredygtigheden. Hvis strømmen derimod kommer fra afbrænding af fossile brændsler, er engangsbatterier bedre, hvilket gælder fx i Indien, som får meget af energien herfra. Dog kan man stille spørgsmålstegn ved, om det er ressourcemæssigt godt ift. hvilke grundstoffer, der bruges i de genopladelige batterier hhv. engangsbatterierne, da de består af forskellige grundstoffer.
Hvad sker der med dine batterier, når de ikke kan bruges eller genoplades mere? I Danmark bliver de sorteret efter, hvordan materialerne i dem kan genanvendes. Herefter sendes de ud af Danmark, hvor de bliver delt op i de dele, der kan genbruges og dem, der ikke kan. Morten Harboe-Jepsen fra Elretur udtaler:
”Metallerne kan genanvendes, men der er et restprodukt, som ikke kan genanvendes – og det bliver brændt på specielle anlæg. Røgen er ikke giftig. Lige nu er det 58 procent af et litium-ion-batteri, som kan genanvendes.”
Danske og udenlandske forskere i kemi forsøger på forskelligt vis at forbedre eksisterende batterier og at udvikle nye typer af batterier i samarbejde med fysikere, matematikere, geologer, biologer og ingeniører. Der er mange måder at forbedre batterier på. Man kan fx arbejde med batteriernes kapacitet, fremstilling, holdbarhed, bortskaffelse og bæredygtighed. Måske har du prøvet opgaven, Forsk og forklar: Fremtidens batterier, hvor du skal forsøge at finde frem til andre grundstoffer end dem, der anvendes i dag. Nogle af disse er nemlig problematiske ift. tilgængelighed, og mange geopolitiske interesser er i spil for at få adgang til mineraler indeholdende disse vigtige grundstoffer.
Nedenfor vil du lære mere om redoxreaktioner, end du allerede ved. Du bygger langsomt ovenpå din viden fra c-niveau om oxidation, reduktion og spændingsrækken vha. regler og detaljerede eksempler. Fokus er i første omgang ikke på batterier, men på at forstå redoxkemi generelt og dermed forberede dig til sidst at dykke ned i, hvordan forskere bruger redoxkemi i arbejdet med at udvikle fremtidens bæredygtige batterier.
3. Hvordan holder man styr på elektronerne?
Redoxreaktioner er en overførsel af elektroner mellem atomer, ioner eller molekyler, hvor den ene partikel afgiver en eller flere elektroner og den anden partikel optager det tilsvarende antal elektroner. Partiklen, der afgiver elektroner, oxideres, mens partiklen, der modtager elektroner, reduceres. De to delreaktioner sker på samme tid. Nedenfor følger to eksempler for at genopfriske dette:
Spændingsrækken kan du bruge til at forudsige, om et metal kan oxideres af et andet metal. Hvis du har en opløsning af jern(3+)ioner og hælder magnesiumspåner deri, vil redoxreaktion (3) ske. Forklaringen er, at magnesium står længst til venstre af de to metaller i spændingsrækken og derfor er mest tilbøjelig til at afgive sine elektroner jern.
| Mg(s) + Fe3+(aq) → Mg2+(aq) + Fe(s) | (3) |
Denne reaktion er ikke afstemt endnu, men hvis reaktionen deles op i to delreaktioner (oxidationsreaktionen og reduktionsreaktionen), kan du se, at magnesium afgiver elektroner og oxideres, mens jern modtager elektroner og reduceres:
| Mg(s) → Mg2+(aq) + 2 e– | (4) |
| Fe3+(aq) + 3 e– → Fe(s) | (5) |
Da elektroner ikke kan eksistere alene, skal antallet af afgivne elektroner og modtagne elektroner være det samme. Mindste fællesnævner, dvs. det laveste tal som både 2 og 3 går op i, er 6. Derfor skal der overføres 6 elektroner:
| 3 Mg(s) → 3 Mg2+(aq) + 6 e– | (6) |
| 2 Fe3+(aq) + 6 e– → 2 Fe(s) | (7) |
Disse to delreaktioner samles til ét reaktionsskema, så alt på venstre side af pilene lægges sammen og alt på højre side lægges sammen. Herefter reduceres reaktionsskemaet, så stoffer, der findes på begge sider af reaktionspilen fjernes:
| 3 Mg(s) + 2 Fe3+(aq) + |
(8) |
Den samlede, afstemte reaktion uden elektronerne bliver derfor:
| 3 Mg(s) + 2 Fe3+(aq) → 3 Mg2+(aq) + 2 Fe(s) | (9) |
Spændingsrækken kan du bruge til at forudsige, om et metal kan oxideres af et andet metal. Hvis du har en opløsning af jern(3+)ioner og hælder magnesiumspåner deri, vil redoxreaktion (3) ske. Forklaringen er, at magnesium står længst til venstre af de to metaller i spændingsrækken og derfor er mest tilbøjelig til at afgive sine elektroner jern.
| Mg(s) + Fe3+(aq) → Mg2+(aq) + Fe(s) | (3) |
Denne reaktion er ikke afstemt endnu, men hvis reaktionen deles op i to delreaktioner (oxidationsreaktionen og reduktionsreaktionen), kan du se, at magnesium afgiver elektroner og oxideres, mens jern modtager elektroner og reduceres:
| Mg(s) → Mg2+(aq) + 2 e– | (4) |
| Fe3+(aq) + 3 e– → Fe(s) | (5) |
Da elektroner ikke kan eksistere alene, skal antallet af afgivne elektroner og modtagne elektroner være det samme. Mindste fællesnævner, dvs. det laveste tal som både 2 og 3 går op i, er 6. Derfor skal der overføres 6 elektroner:
| 3 Mg(s) → 3 Mg2+(aq) + 6 e– | (6) |
| 2 Fe3+(aq) + 6 e– → 2 Fe(s) | (7) |
Disse to delreaktioner samles til ét reaktionsskema, så alt på venstre side af pilene lægges sammen og alt på højre side lægges sammen. Herefter reduceres reaktionsskemaet, så stoffer, der findes på begge sider af reaktionspilen fjernes:
| 3 Mg(s) + 2 Fe3+(aq) + |
(8) |
Den samlede, afstemte reaktion uden elektronerne bliver derfor:
| 3 Mg(s) + 2 Fe3+(aq) → 3 Mg2+(aq) + 2 Fe(s) | (9) |
Se mere
I eksempel 2 gennemgås en reaktion, hvor det ikke er et metal, der reagerer med et andet metal, men derimod et ikke-metal og et metal.
Måske har du lagt mærke til, at mange gamle bygninger, som Sankt Pauls Kirke i Aarhus (se figur 6), har grønne tage. Det er kobbertage, som starter med at have kobbers rødlige farve, men som over tid oxideres og bliver grønt.

Her er der tale om en oxidation af kobber i flere komplekse reaktioner, der påvirkes af luftfugtighed, luftens indhold af svovl- og nitrogenholdige gasser samt indhold af fx små saltvandspartikler, hvis kobberet er i nærheden af havvand. Herudover påvirker dioxygen og carbondioxid i luften også oxidationen af kobber. Farven på kobbertagene skyldes flere forskellige kobberforbindelser og blandinger af disse. Her følger eksempler på disse:
Cu2CO3(OH)2 (grøn farve, malakit)
Cu4SO4(OH)6 (grøn farve)
Cu3(CO3)2(OH)2 (blå farve, azurit)
Den første forbindelse, malakit, opstår på kobbertagene gennem tre reaktioner. Kobber reagerer både med luftens dioxygen og carbondioxid. I figur 7 kan du se de tydelige farver på de to kobberoxider, der er produkter fra reaktion (10) og (11).
| 4 Cu(s) + O2(g) → 2 Cu2O(s) (rød) | (10) |
| 2 Cu2O(s) + O2(g) → 4 CuO(s) (sort) | (11) |
| 2 CuO(s) + CO2(g) + H2O(l) → Cu2CO3(OH)2(s) (grøn) | (12) |
Hvis reaktion (10) deles op i to delreaktioner (oxidationsreaktionen og reduktionsreaktionen), kan du se, at kobber afgiver elektroner og oxideres, mens dioxygen modtager elektroner og reduceres:
| Cu(s) → Cu+(aq) + e– | (13) |
| O2(g) + 4 e– → 2 O2-(aq) | (14) |
Et kobberatom afgiver en elektron, og hvert oxygenatom i dioxygen modtager 2 elektroner, dvs. i alt 4 elektroner. Dermed skal der oxideres fire kobberatomer, hver gang et dioxygenmolekyle reduceres, som vist i den afstemte reaktion (10).

Måske har du lagt mærke til, at mange gamle bygninger, som Sankt Pauls Kirke i Aarhus (se figur 6), har grønne tage. Det er kobbertage, som starter med at have kobbers rødlige farve, men som over tid oxideres og bliver grønt.

Her er der tale om en oxidation af kobber i flere komplekse reaktioner, der påvirkes af luftfugtighed, luftens indhold af svovl- og nitrogenholdige gasser samt indhold af fx små saltvandspartikler, hvis kobberet er i nærheden af havvand. Herudover påvirker dioxygen og carbondioxid i luften også oxidationen af kobber. Farven på kobbertagene skyldes flere forskellige kobberforbindelser og blandinger af disse. Her følger eksempler på disse:
Cu2CO3(OH)2 (grøn farve, malakit)
Cu4SO4(OH)6 (grøn farve)
Cu3(CO3)2(OH)2 (blå farve, azurit)
Den første forbindelse, malakit, opstår på kobbertagene gennem tre reaktioner. Kobber reagerer både med luftens dioxygen og carbondioxid. I figur 7 kan du se de tydelige farver på de to kobberoxider, der er produkter fra reaktion (10) og (11).
| 4 Cu(s) + O2(g) → 2 Cu2O(s) (rød) | (10) |
| 2 Cu2O(s) + O2(g) → 4 CuO(s) (sort) | (11) |
| 2 CuO(s) + CO2(g) + H2O(l) → Cu2CO3(OH)2(s) (grøn) | (12) |
Hvis reaktion (10) deles op i to delreaktioner (oxidationsreaktionen og reduktionsreaktionen), kan du se, at kobber afgiver elektroner og oxideres, mens dioxygen modtager elektroner og reduceres:
| Cu(s) → Cu+(aq) + e– | (13) |
| O2(g) + 4 e– → 2 O2-(aq) | (14) |
Et kobberatom afgiver en elektron, og hvert oxygenatom i dioxygen modtager 2 elektroner, dvs. i alt 4 elektroner. Dermed skal der oxideres fire kobberatomer, hver gang et dioxygenmolekyle reduceres, som vist i den afstemte reaktion (10).

Se mere
Hvor længe skal vi i dag vente på, at taget på Sankt Pauls Kirke i Aarhus og andre bygninger med relativt nylagte kobbertage bliver grønt? Hvad er forklaringen? Find svarene i denne artikel fra Ingeniøren.
Se mere
Nedenfor er to forsøg, hvor du kan undersøge, om man kan gøre noget for at få nye kobbertage til at irres hurtigere. I det første forsøg undersøger du en specifik reaktion, og i det andet forsøg vælger du selv forskellige stoffer, du vil undersøge potentialet af, og du bestemmer selv forsøgsbetingelserne.
Du skal afprøve en metode til at gøre kobbertage grønne på meget kort tid og vurdere, om metoden er god.
(Du skal scrolle lidt ned på siden, du kommer ind på.)
Kan du selv finde frem til den bedste opskrift på grønne kobbertage?
(Du skal scrolle lidt ned på siden, du kommer ind på.)
Det bliver sværere og sværere at holde regnskab med antallet af overførte elektroner, jo mere komplicerede redoxreaktionerne bliver. Du skal stadig have styr på, hvilket grundstof der oxideres, og hvilket der reduceres samt på, at der afgives lige mange elektroner, som der optages i en reaktion. Nedenfor lærer du først en regel for, hvordan du ofte afgør hvilke atomer, der afgiver, og hvilke der optager elektronerne. Her skal du bruge begrebet elektronegativitet, som du måske har mødt før. Bagefter lærer du et system, hvor du bruger begrebet oxidationstal til at holde styr på elektronerne i redoxreaktioner, så du kan afstemme dem.
Tidligere har du måske set, at meget elektronegative grundstoffer som f.eks. oxygen er effektivt til at oxidere mange stoffer. Men hvad er det nu elektronegativitet betyder?
Helt kort kan man sige, at elektronegativitet er et udtryk for et atoms evne til at tiltrække elektroner. Elektronegativitet forkortes ofte med EN og har en talværdi mellem 0 og 4. EN-værdien er enhedsløs, og jo højere talværdien er, jo mere elektronegativt er grundstoffet. Du kan læse mere om elektronegativitet her. I figur 8 kan du se EN-værdien for mange af grundstofferne.
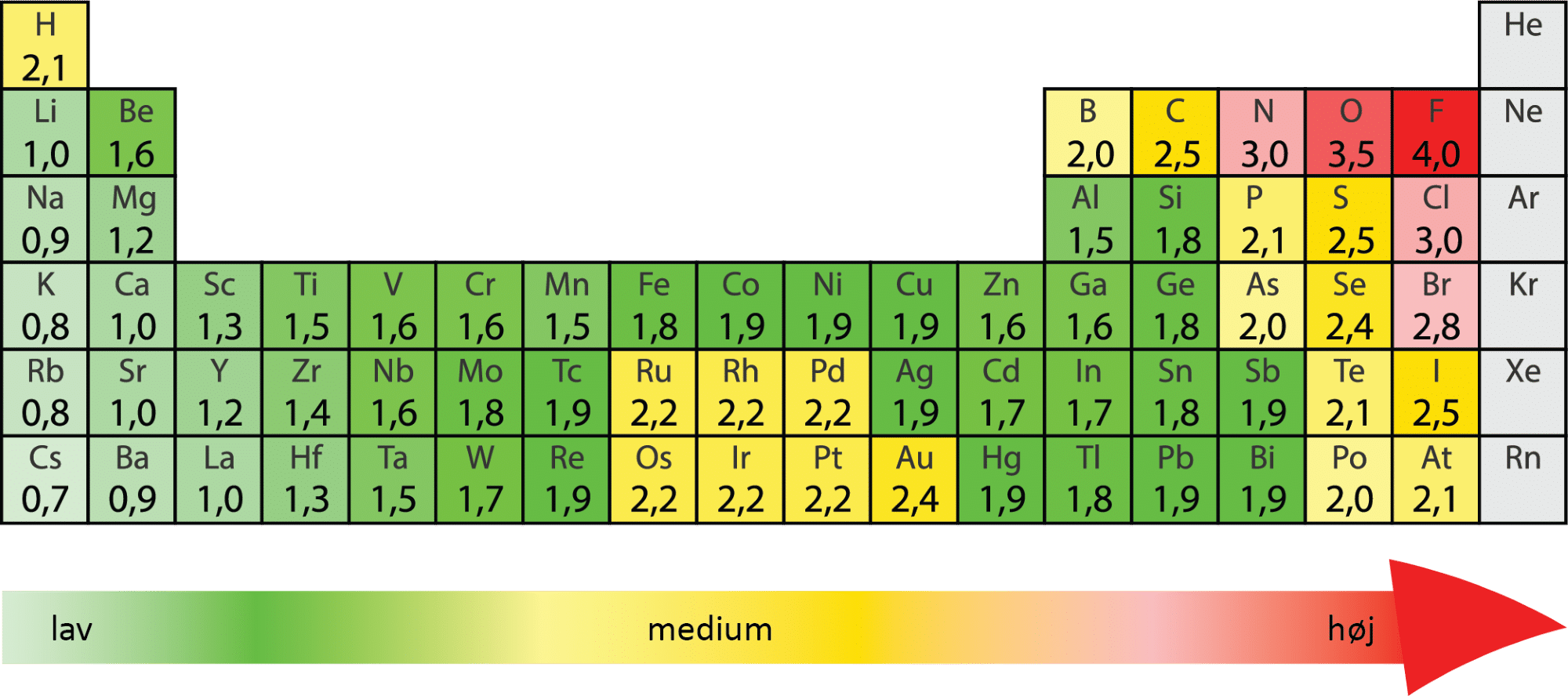
I ”Kemiske bindinger” er det gennemgået, hvordan du bruger forskellen i EN-værdier mellem to grundstoffer til at afgøre, hvilken type af kemisk binding de laver med hinanden. Elektronerne i en binding vil i større eller mindre grad være forskudt mod det mest elektronegative atom, medmindre forskellen i EN-værdierne er 0. I redoxreaktioner svarer det til, at det mest elektronegative atom dermed reduceres, og det mindst elektronegative atom oxideres. Lad os se på et eksempel:
I reaktion (15) skal vi finde ud af, om kobberatomerne og oxygenatomerne oxideres eller reduceres:
| 2 Cu(s) + O2(g) → 2 CuO(s) | (15) |
I figur 8 kan vi finde begge grundstoffers EN-værdi:
| EN(Cu) = 1,9 |
| EN(O) = 3,5 |
Da EN-værdien er højest for oxygen, reduceres det, mens kobber oxideres.
I reaktion (15) skal vi finde ud af, om kobberatomerne og oxygenatomerne oxideres eller reduceres:
| 2 Cu(s) + O2(g) → 2 CuO(s) | (15) |
I figur 8 kan vi finde begge grundstoffers EN-værdi:
| EN(Cu) = 1,9 |
| EN(O) = 3,5 |
Da EN-værdien er højest for oxygen, reduceres det, mens kobber oxideres.
Se mere
Reaktion (16) og (17) er eksempler på redoxreaktioner med grundstoffer, der har høje EN-værdier, som ikke er oxygen, og som reagerer med henholdsvis jern og kobber. Grundstoffer med en høj EN-værdi kaldes også elektronegative grundstoffer.
| 2 Fe(s) + 3 Cl2(g) → 2 FeCl3(s) | (16) |
| Cu(s) + Br2(g) → CuBr2(s) | (17) |
a. Find EN-værdierne for grundstofferne, der indgår i reaktion (16), og afgør hvilket grundstof, der oxideres og hvilket der reduceres. Gør tilsvarende for grundstofferne i reaktion (17).
b. Opskriv delreaktionerne for reaktion (16) og bagefter reaktion (17) ligesom vist i reaktionerne (6) + (7) og (13) + (14).
c. Argumenter for koefficienterne i reaktion (16), som det også gøres i eksempel 1 og 2.
Se mere
Du har nu set, at det er elektronegativiteten, der er med til at afgøre, hvorvidt et atom reduceres eller oxideres. Men for at finde ud af ”hvor meget” det reduceres eller oxideres, er du nødt til at have styr på alle elektronerne, der afgives og optages i en reaktion, og her er oxidationstal et smart, lille værktøj.
Oxidationstal (OT) er et redskab, man har indført, og som kan tildeles alle atomer i en kemisk reaktion. Du skal lære, hvordan OT kan hjælpe dig med at følge fordelingen af elektroner mellem atomerne, og hvordan OT ændrer sig for nogle atomer i løbet af en reaktion.
Du har tidligere set, at når et atom oxideres, reduceres et andet atom samtidig. Det kan kobles sammen med fagudtrykket oxidationstal:
Når et atom oxideres i en reaktion, stiger OT, og når et atom reduceres, falder OT.
Hvis et atoms OT stiger i en reaktion, vil et andet atoms OT samtidig falde.
Hvis et atom ændrer OT i løbet af en reaktion, er der altid tale om en redoxreaktion.
Når et atom oxideres i en reaktion, stiger OT, og når et atom reduceres, falder OT.
Hvis et atoms OT stiger i en reaktion, vil et andet atoms OT samtidig falde.
Hvis et atom ændrer OT i løbet af en reaktion, er der altid tale om en redoxreaktion.
Se mere
OT tildeles til enkeltatomer eller atomer i molekyler og ionforbindelser efter meget præcise regler. OT er som regel hele tal fra -7 til +7 og de angives oftest med romertal for at skelne mellem ladninger og OT (se figur 24 i faktaboksen nedenfor). De skrives over atomet i et reaktionsskema, og det er vigtigt at sætte fortegn + eller – foran romertallet. Dermed bruges romertallene I, II, III, IV, V, VI og VII med et fortegn samt tallet 0, som ikke er et romertal.
Et gammelt talsystem fra Romerriget
Romertal er et talsystem, som blev udviklet i Romerriget. Romerriget var et oldtidsrige (ca. 500 f.Kr. – 500 e.Kr.) med udgangspunkt i Rom, og som bredte sig langt ud over Italiens nuværende grænser. Romertallene skrives med bestemte bogstaver og kun med stort, som ses i figur 9.
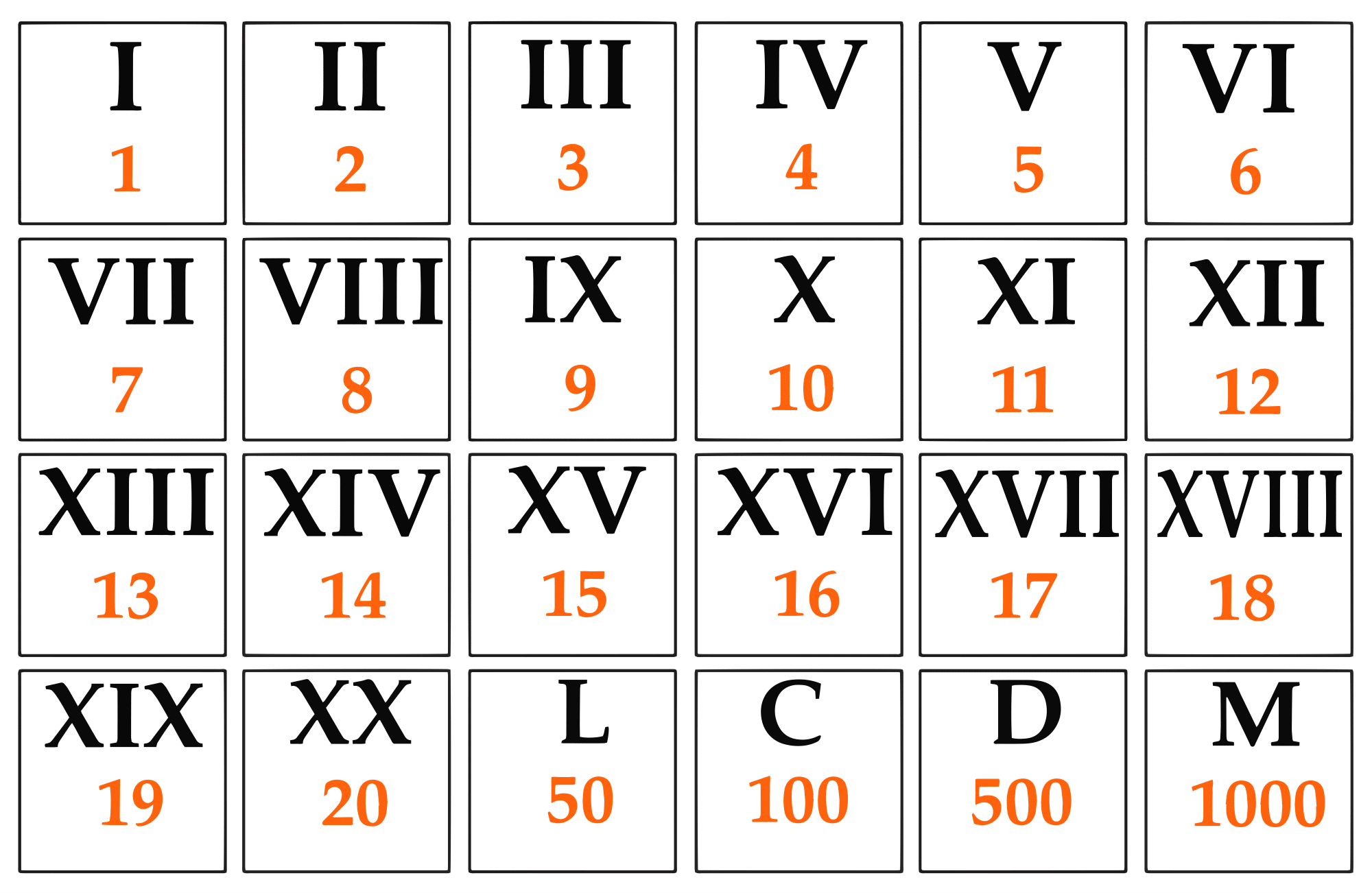
I er bogstavet for tallet 1.
II er bogstavet for tallet 2, da du skal forstille dig at lægge de to tal sammen:
I + I = 2
Det samme gælder for III:
I + I + I = 3
Men hvad så med 4? I figur 24 står der IV. Og V er bogstavet for tallet 5. Et foranstillet, mindre talbogstav (I) skal trækkes fra et større, efterstillet talbogstav (V). Så IV skal læses:
V – I = 4
Hvis du vil skrive tallet for figurnummer 24, skal du skrive XXIV, fordi XX betyder
X + X = 20
og IV betyder
V – I = 4
Derfor betyder XXIV
X + X + V – I = 24
År 2000 skrives derfor som MM, mens år 1999 skrives som MCMXCIX, fordi MCM betyder
M + M – C = 1900
og XC betyder
C – X = 90
og IX betyder
X – I = 9
Derfor betyder MCMXCIX 1999.
Se mere

Kan du mon skrive dit fødselsår med romertal?
Se mere
Når du skal tildele et OT enten til et enkeltatom eller atomer, er der tradition for at bruge romertal. Det er dog ikke noget, du skal, men kan gøre. Det kan dog hjælpe dig med at skelne mellem fx ioners ladning og atomers OT. Du kan følge disse regler:
Tildeling af oxidationstal
1. Oxidationstallet for hvert atom i et grundstof er 0.
2. Oxidationstallet for en simpel ion svarer til ionens ladning.
3. For et molekyle eller en ionforbindelse er summen af oxidationstal for atomerne 0.
4. Hydrogens OT er
a. +I, når det er bundet til et mere elektronegativt atom.
b. -I, når det er bundet til et mindre elektronegativt atom.
5. Oxygens OT er
a. -II, når det er bundet til et mindre elektronegativt grundstof.
b. -I, når det indgår i såkaldte peroxider.
6. For en sammensat ion svarer summen af oxidationstal for atomerne til ionens ladning.
Tildeling af oxidationstal
1. Oxidationstallet for hvert atom i et grundstof er 0.
2. Oxidationstallet for en simpel ion svarer til ionens ladning.
3. For et molekyle eller en ionforbindelse er summen af oxidationstal for atomerne 0.
4. Hydrogens OT er
a. +I, når det er bundet til et mere elektronegativt atom.
b. -I, når det er bundet til et mindre elektronegativt atom.
5. Oxygens OT er
a. -II, når det er bundet til et mindre elektronegativt grundstof.
b. -I, når det indgår i såkaldte peroxider.
6. For en sammensat ion svarer summen af oxidationstal for atomerne til ionens ladning.
Se mere
For at kunne bruge reglerne, kan du med fordel læse eksempel 4. Læg mærke til, at selvom der er to ens hydrogenatomer i fx vandmolekylet, så skrives der kun OT ovenover vandmolekylet for ét af hydrogenatomerne.
1. Oxidationstallet for hvert atom i et grundstof er 0.
![]()
I dioxygenmolekylet er der to oxygenatomer, og de har hver et OT på 0. Det samme gælder hvert af de 8 svovlatomer i cyklooctasvovl.
2. Oxidationstallet for en simpel ion svarer til ionens ladning.
![]()
I alle fire simple ioner svarer OT ovenover til ionens ladning således, at chlorid, som har ladningen -1, har et OT på -I.
3. For et molekyle eller en ionforbindelse er summen af oxidationstal for atomerne 0.
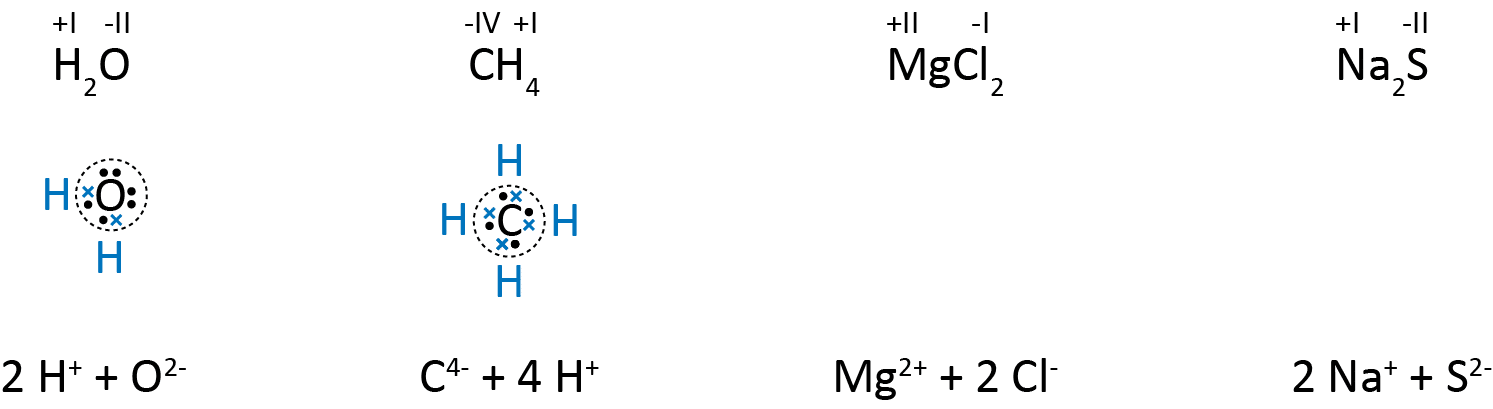
I vand- og methanmolekylerne er atomerne bundet sammen med elektronparbindinger, dvs. atomerne deles om elektronerne. De sorte prikker er oxygen- og carbonatomernes elektroner i yderste skal, mens de blå krydser er hydrogenatomernes ene elektron. Ved tildeling af OT til atomerne i fx vandmolekylet er det lettest, at du forestiller dig, at de fælles elektronpar overføres helt fra hydrogenatomerne til oxygenatomerne, da oxygen er mere elektronegativt end hydrogen. Dette er illustreret med den den stiplede cirkel. Det samme gælder for methanmolekylet. Nederst er derfor vist, hvordan du kan forestille dig, at vand er opbygget af 2 hydroner og 1 oxid, og at methan er opbygget av 1 carbid og 4 hydroner.
Magnesiumchlorid og natriumsulfid er begge ionforbindelser, og her sker en overførsel af elektronerne helt fra det mindst elektronegative atom til det mest elektronegative atom, dvs. fra magnesium til chlor og fra natrium til svovl.
4. Hydrogens OT er
a. +I, når det er bundet til et mere elektronegativt atom.
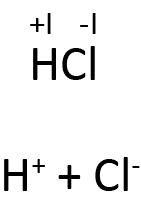
I hydrogenchlorid er chloratomet mere elektronegativt end hydrogenatomet, og du kan derfor forestille dig, at molekylet er opbygget af 1 hydron og 1 chlorid. Derfor får hydrogenatomet et OT på +I. Dermed må chloratomet få et OT på -I, da summen af oxidationstallene skal give molekylets ladning, som er nul (regel 3).
b. -I, når det er bundet til et mindre elektronegativt atom.

I lithiumhydrid er hydrogenatomet mere elektronegativt end lithiumatomet, og du kan derfor forestille dig, at molekylet er opbygget af 1 litiumion og 1 hydrid. Derfor får hydrogenatomet et OT på -I. Dermed må lithiumatomet få et OT på +I, da summen af oxidationstallene skal give molekylets ladning, som er nul (regel 3).
5. Oxygens OT er
a. -II, når det er bundet til et mindre elektronegativt grundstof.

I carbondioxidmolekylet er atomerne bundet sammen med dobbeltbindinger. De sorte prikker er carbonatomets elektroner i yderste skal, mens de blå krydser er oxygenatomernes elektroner i yderste skal. Ved tildeling af OT til atomerne i molekylet er det lettest, at du forestiller dig, at de fælles elektronpar overføres helt fra carbonatomet til oxygenatomerne, da oxygen er mere elektronegativt end hydrogen. Dette er illustreret med den de stiplede cirkler. Du kan derfor forestille dig, at molekylet er opbygget af 1 C4+-ion og 2 oxid. Derfor får oxygenatomet et OT på -II. Dermed må carbonatomet få et OT på +IV, da summen af oxidationstallene skal give molekylets ladning, som er nul (regel 3).
b. -I, når det indgår i såkaldte peroxider
Peroxider er kemiske forbindelser, hvor to oxygenatomer (vist med rød nedenfor) er bundet sammen med en enkeltbinding, og hvert oxygenatom er bundet til to ens eller forskellige atomer symboliseret med R1 og R2. Peroxidionen til højre, vist i rødt, har en ladning på -2, dvs. OT for hele ionen er -II og dermed må OT for de enkelte oxygenatomer i ionen være -I.
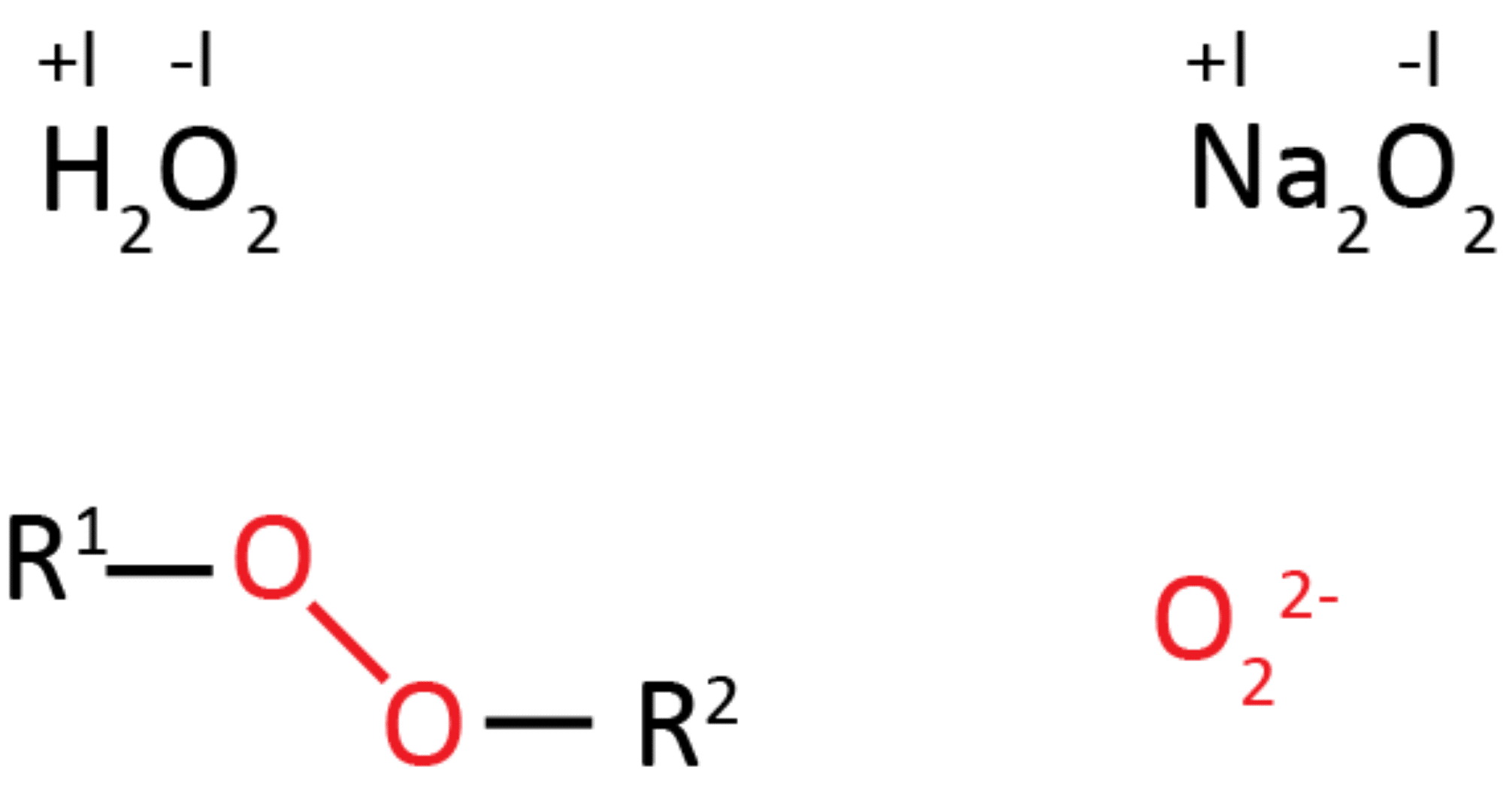
I molekylet hydrogenperoxid nederst til venstre får oxygenatomet et OT på -I. Dermed må hydrogenatomet få et OT på +I, da summen af oxidationstallene skal give molekylets ladning, som er nul (regel 3). Det samme gælder for metalperoxiden, natriumperoxid.
6. For en sammensat ion svarer summen af oxidationstal for atomerne til ionens ladning.
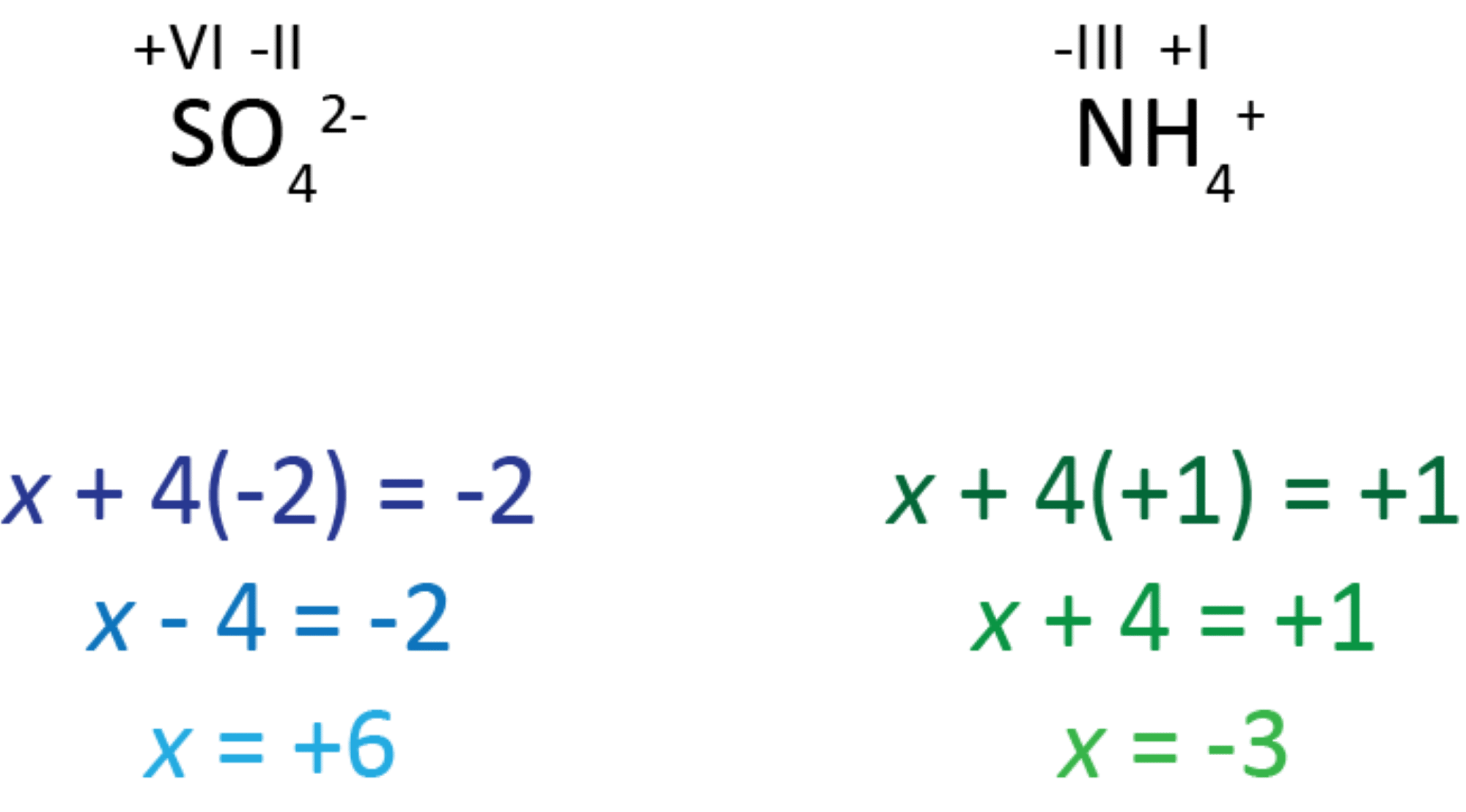
I den sammensatte sulfation er oxygen mere elektronegativt end svovl, og derfor kan du bruge regel nr. 5a ovenfor. Oxygen får et OT på -II. Men hvilket OT får svovlatomet? Hvis du til at starte med kalder det for x, så kan du løse denne matematiske ligning:
x + 4(-2) = -2
x er svovls OT,
4(-2) svarer til, at der er 4 oxygenatomer med hver deres OT på -2,
ionens ladning er -2.
Til sidst kommer du frem til, at værdien af svovls OT er +6, og derfor står der +VI ovenover svovlatomet i sulfat.
I den sammensatte ammoniumion er hydrogen mindre elektronegativt end nitrogen, og derfor kan du bruge regel nr. 4a ovenfor. Hydrogen får et OT på +I. Men hvilket OT får nitrogenatomet? Hvis du til at starte med kalder det for x, så kan du løse den matematiske ligning,
x + 4(+1) = +1
x er nitrogens OT
4(+1) svarer til, at der er 4 hydrogenatomer med hver deres OT på +1,
ionens ladning er +1.
Til sidst kommer du frem til, at værdien af nitrogens OT er -3, og derfor står der -III ovenover nitrogenatomet i ammonium.
1. Oxidationstallet for hvert atom i et grundstof er 0.
![]()
I dioxygenmolekylet er der to oxygenatomer, og de har hver et OT på 0. Det samme gælder hvert af de 8 svovlatomer i cyklooctasvovl.
2. Oxidationstallet for en simpel ion svarer til ionens ladning.
![]()
I alle fire simple ioner svarer OT ovenover til ionens ladning således, at chlorid, som har ladningen -1, har et OT på -I.
3. For et molekyle eller en ionforbindelse er summen af oxidationstal for atomerne 0.
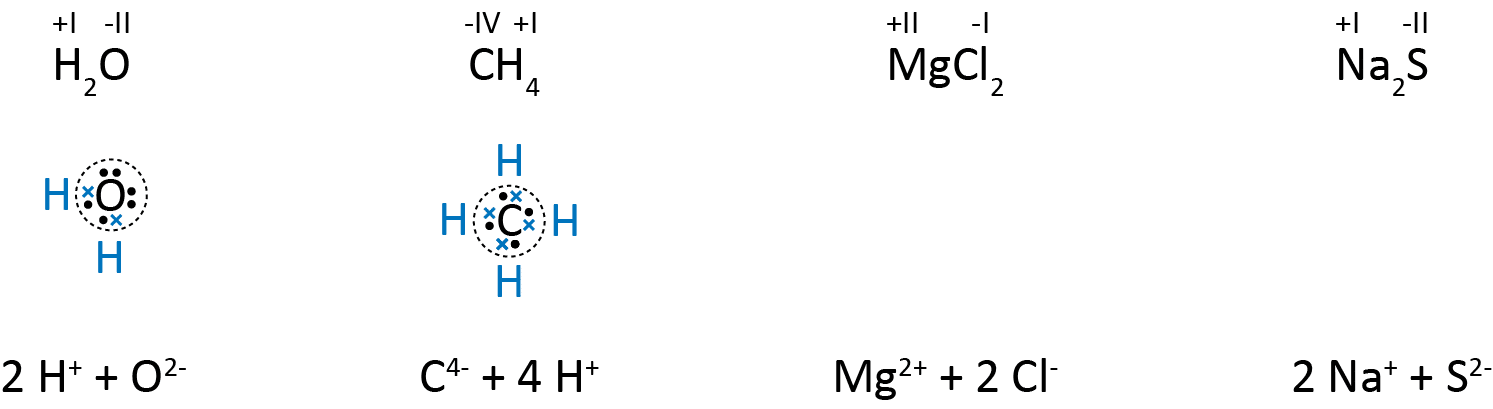
I vand- og methanmolekylerne er atomerne bundet sammen med elektronparbindinger, dvs. atomerne deles om elektronerne. De sorte prikker er oxygen- og carbonatomernes elektroner i yderste skal, mens de blå krydser er hydrogenatomernes ene elektron. Ved tildeling af OT til atomerne i fx vandmolekylet er det lettest, at du forestiller dig, at de fælles elektronpar overføres helt fra hydrogenatomerne til oxygenatomerne, da oxygen er mere elektronegativt end hydrogen. Dette er illustreret med den den stiplede cirkel. Det samme gælder for methanmolekylet. Nederst er derfor vist, hvordan du kan forestille dig, at vand er opbygget af 2 hydroner og 1 oxid, og at methan er opbygget av 1 carbid og 4 hydroner.
Magnesiumchlorid og natriumsulfid er begge ionforbindelser, og her sker en overførsel af elektronerne helt fra det mindst elektronegative atom til det mest elektronegative atom, dvs. fra magnesium til chlor og fra natrium til svovl.
4. Hydrogens OT er
a. +I, når det er bundet til et mere elektronegativt atom.
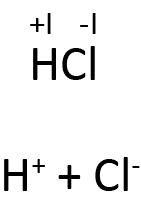
I hydrogenchlorid er chloratomet mere elektronegativt end hydrogenatomet, og du kan derfor forestille dig, at molekylet er opbygget af 1 hydron og 1 chlorid. Derfor får hydrogenatomet et OT på +I. Dermed må chloratomet få et OT på -I, da summen af oxidationstallene skal give molekylets ladning, som er nul (regel 3).
b. -I, når det er bundet til et mindre elektronegativt atom.

I lithiumhydrid er hydrogenatomet mere elektronegativt end lithiumatomet, og du kan derfor forestille dig, at molekylet er opbygget af 1 litiumion og 1 hydrid. Derfor får hydrogenatomet et OT på -I. Dermed må lithiumatomet få et OT på +I, da summen af oxidationstallene skal give molekylets ladning, som er nul (regel 3).
5. Oxygens OT er
a. -II, når det er bundet til et mindre elektronegativt grundstof.

I carbondioxidmolekylet er atomerne bundet sammen med dobbeltbindinger. De sorte prikker er carbonatomets elektroner i yderste skal, mens de blå krydser er oxygenatomernes elektroner i yderste skal. Ved tildeling af OT til atomerne i molekylet er det lettest, at du forestiller dig, at de fælles elektronpar overføres helt fra carbonatomet til oxygenatomerne, da oxygen er mere elektronegativt end hydrogen. Dette er illustreret med den de stiplede cirkler. Du kan derfor forestille dig, at molekylet er opbygget af 1 C4+-ion og 2 oxid. Derfor får oxygenatomet et OT på -II. Dermed må carbonatomet få et OT på +IV, da summen af oxidationstallene skal give molekylets ladning, som er nul (regel 3).
b. -I, når det indgår i såkaldte peroxider
Peroxider er kemiske forbindelser, hvor to oxygenatomer (vist med rød nedenfor) er bundet sammen med en enkeltbinding, og hvert oxygenatom er bundet til to ens eller forskellige atomer symboliseret med R1 og R2. Peroxidionen til højre, vist i rødt, har en ladning på -2, dvs. OT for hele ionen er -II og dermed må OT for de enkelte oxygenatomer i ionen være -I.

I molekylet hydrogenperoxid nederst til venstre får oxygenatomet et OT på -I. Dermed må hydrogenatomet få et OT på +I, da summen af oxidationstallene skal give molekylets ladning, som er nul (regel 3). Det samme gælder for metalperoxiden, natriumperoxid.
6. For en sammensat ion svarer summen af oxidationstal for atomerne til ionens ladning.
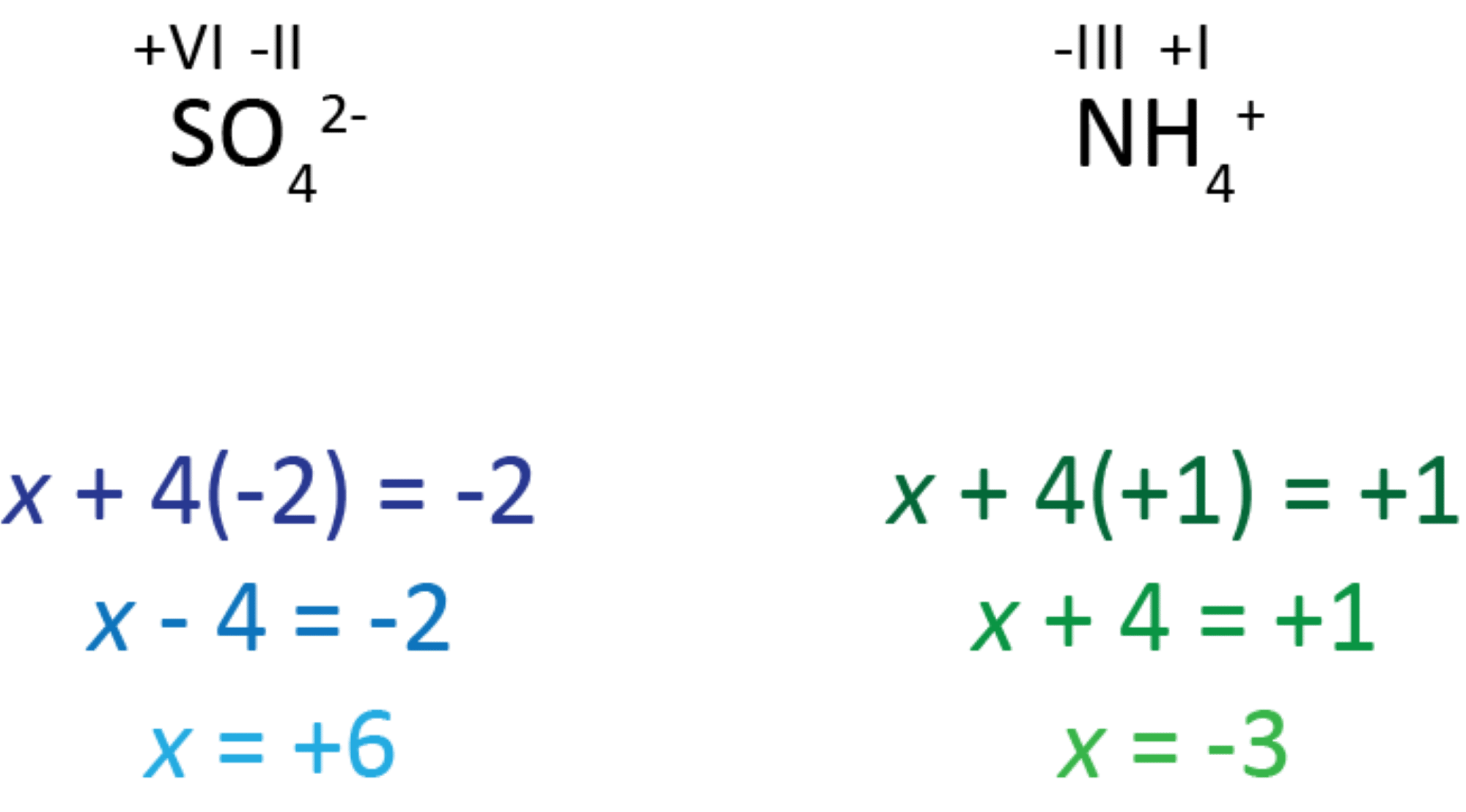
I den sammensatte sulfation er oxygen mere elektronegativt end svovl, og derfor kan du bruge regel nr. 5a ovenfor. Oxygen får et OT på -II. Men hvilket OT får svovlatomet? Hvis du til at starte med kalder det for x, så kan du løse denne matematiske ligning:
x + 4(-2) = -2
x er svovls OT,
4(-2) svarer til, at der er 4 oxygenatomer med hver deres OT på -2,
ionens ladning er -2.
Til sidst kommer du frem til, at værdien af svovls OT er +6, og derfor står der +VI ovenover svovlatomet i sulfat.
I den sammensatte ammoniumion er hydrogen mindre elektronegativt end nitrogen, og derfor kan du bruge regel nr. 4a ovenfor. Hydrogen får et OT på +I. Men hvilket OT får nitrogenatomet? Hvis du til at starte med kalder det for x, så kan du løse den matematiske ligning,
x + 4(+1) = +1
x er nitrogens OT
4(+1) svarer til, at der er 4 hydrogenatomer med hver deres OT på +1,
ionens ladning er +1.
Til sidst kommer du frem til, at værdien af nitrogens OT er -3, og derfor står der -III ovenover nitrogenatomet i ammonium.
Se mere
De mest elektronegative grundstoffer får altså et negativt oxidationstal, mens de mindre elektronegative får et positivt oxidationstal. Fx har alle alkalimetallerne i første gruppe i det periodiske system altid et oxidationstal på +I og jordalkalimetallerne i anden gruppe næsten altid har +II.
Hvis atomer af grundstofferne i første gruppe i det periodiske system har et OT på +I i kemiske forbindelser, og dem i anden gruppe får et OT på +II i kemiske forbindelser, hvordan kan du da forklare, at atomerne af grundstofferne i syttende gruppe, hvilket svarer til 7. hovedgruppe (halogenerne), nogle gange kan have et OT på +VII og -I i kemiske forbindelser? Kan du finde og forklare sammenhængen mellem OT og hovedgruppenummeret?
Se mere
Tildel oxidationstal til atomerne i følgende forbindelser på samme måde som i eksempel 4, og find navnene på de forbindelser, der mangler i skemaet nedenfor.

Se mere
natriumhypochlorit er et stærkt oxidationsmiddel og er den aktive ingrediens i klorin, der bruges til rengøring, desinfektion og afblegning? Hypochlorit er det desinfektionsmiddel, der bruges i svømmehallen.
Nu har du set, at du kan bruge EN-værdier til at finde frem til oxidationstal. Der er dog sjældent regler uden undtagelser! En del grundstoffer, både metaller, ikke-metaller og nogle overgangsmetaller kan have flere forskellige oxidationstal, alt efter hvilke andre atomer der er i molekylet eller ionen. I spændingsrækken kan du se to forskellige jernioner og to forskellige kobberioner (se figur 10). Der er tale om jern(2+)-, jern(3+)-, kobber(1+)- og kobber(2+)ionerne. For at undgå at blande fx jern(2+)- og jern(3+)ionerne sammen, indgår ladningen i selve ionernes navne. I anden litteratur kan du opleve, at der i stedet for ladningen står ionernes OT med romertal i parentesen: jern(II)ion og jern(III)ion.

Hvis atomerne i et grundstof kan have flere OT, kan man ikke altid bruge EN-værdien til at afgøre, hvilke stoffer der oxideres og hvilke der reduceres. Men du kan som udgangspunkt regne med, at du kan bruge det, når du er i tvivl.
OT er, som tidligere nævnt, et system, man har indført for at følge fordelingen af elektroner mellem atomerne i stoffer og hvordan disse ændres i en given redoxreaktion. Skifter OT for et atom i en reaktion, så er der sket en redoxreaktion.
I eksempel 5 er det vist, hvordan OT skrives i en redoxreaktion.
Eksempel 5
I den redoxreaktion, der foregik i Voltas batteri (18), bliver zink oxideret og kobber reduceret, da kobber er det mest elektronegative atom af de to. I reaktionen, som er vist nedenfor, er OT sat ind ovenover alle atomerne. Du kan se, at OT for zink går fra 0 til +II og at OT for kobber går fra +II til 0. Da der er tale om en ændring i OT for et atom, er der tale om en redoxreaktion.
| 0 +II +II 0
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s) |
(18) |
Eksempel 5
I den redoxreaktion, der foregik i Voltas batteri (18), bliver zink oxideret og kobber reduceret, da kobber er det mest elektronegative atom af de to. I reaktionen, som er vist nedenfor, er OT sat ind ovenover alle atomerne. Du kan se, at OT for zink går fra 0 til +II og at OT for kobber går fra +II til 0. Da der er tale om en ændring i OT for et atom, er der tale om en redoxreaktion.
| 0 +II +II 0
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s) |
(18) |
Se mere
Hvis du har set demoforsøget, hvor metallisk natrium reagerer kraftigt med vand, kender du allerede reaktionen. Ellers kan du se denne video:
I filmen sammenligner Peter Hald, sikkerhedsleder på Institut for Kemi, Aarhus Universitet, lithium, natrium og kaliums reaktion med vand. Som du kan se i videoen til sidst, er reaktionen eksplosiv, når metallisk natrium kommes i vand. Ingen kom til skade under forsøget. Reaktionen er denne redoxreaktion:
| 2 Na(s) + 2 H2O(l) → 2 Na+(aq) + 2 OH–(aq) + H2(g) | (19) |
Se mere
Når man opskriver mere komplicerede redoxreaktioner, skriver man kun OT over de atomer, der enten stiger eller falder i OT. OT for atomer, der ikke ændres, har ikke betydning for, hvordan reaktionen opskrives og afstemmes, som du skal lære om længere nede.
Når du tildeler OT i organiske redoxreaktioner, foregår det langt hen ad vejen på samme måde, som du allerede har lært. Dog er nogle organiske stoffer meget store, og så bliver det hurtigt en uoverskuelig opgave at udføre. Se fx strukturen af testosteron i figur 11 med molekylformlen C19H28O2.
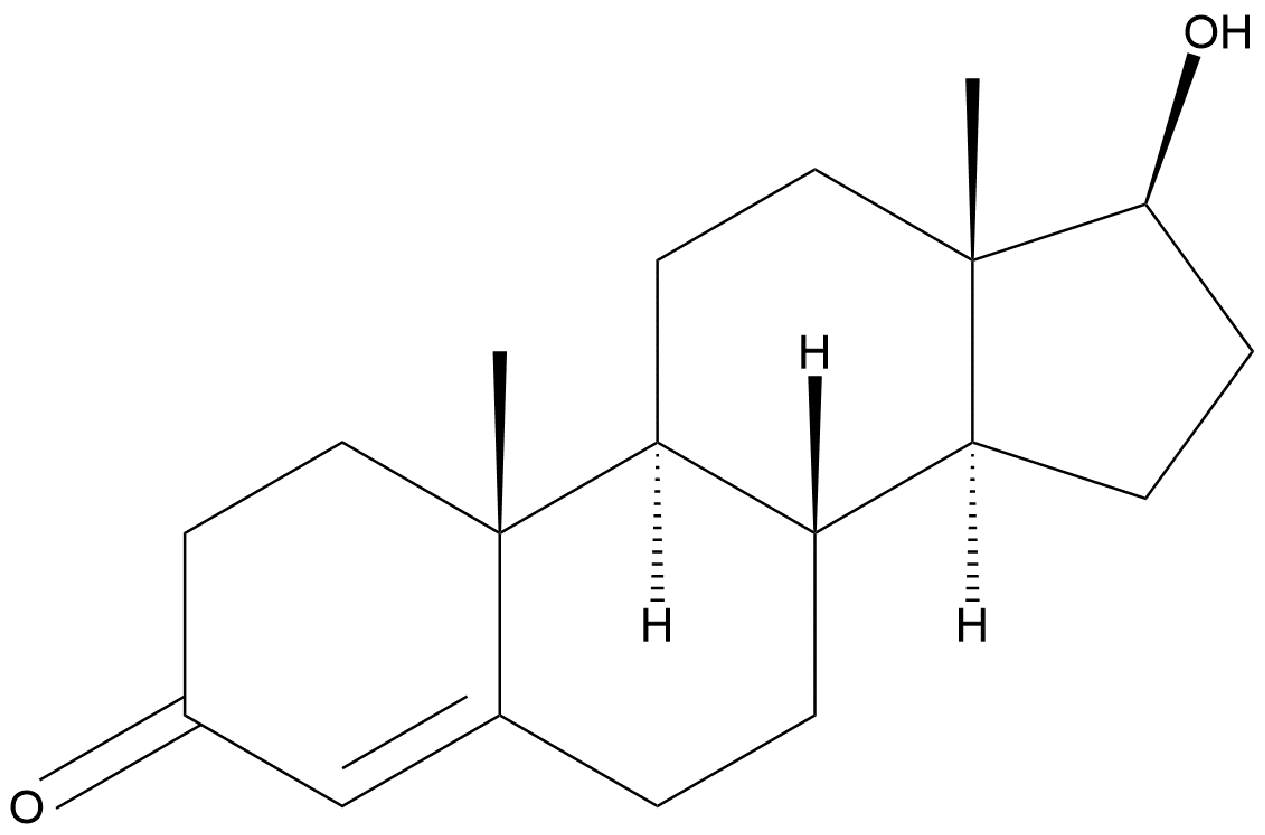
hos mænd oxideres testosteron til østradiol, der er et af de primære kvindelige kønshormoner? Det sker ved en redoxreaktion, hvor dioxygen samtidig reduceres. Oxygenatomerne skifter OT fra 0 til -II. Kvinder har også det mandlige kønshormon, testosteron.
Hvis du vil lære, hvordan du tildeler OT til organiske forbindelser, kan du læse mere om det i temaet ’Power-to-X og katalyse’.
Afstemning af reaktionsskemaer er en helt central del af kemi, og i næste afsnit lærer du en række regler, der systematiserer afstemningen, så det bliver lettere.
Når der sker en redoxreaktion, er det vigtigt, at du har styr på, at der afgives lige mange elektroner fra det stof, der oxideres, som der optages af det stof, der reduceres. Her følger en række regler, du kan følge, og bagefter ser du eksempler på dette i en video.
Afstemningsregler
1. Skriv reaktionsskemaet med reaktanter, produkter og tilstandsformer men uden koefficienter.
2. Bestem OT for de atomer, der ændrer oxidationstal.
3. Afstem antallet af afgivne og optagne elektroner.
a. Den samlede stigning i OT (antal afgivne elektroner) skal svare til det samlede fald i OT (antal af optagne elektroner). Dette justeres med at sætte koefficienter foran reaktanter og produkter.
4. Kontrollér, at antallet af ens atomer er det samme på begge sider af reaktionspilen bortset fra hydrogen og oxygen.
5. Afstem ladning på begge sider af reaktionspilen.
a. I sur opløsning afstemmes med hydroner, H+.
b. I basisk opløsning afstemmes med hydroxid, OH–.
c. I neutral opløsning afstemmes enten med hydroner eller hydroxid på produktsiden af reaktionen, afhængig af, om der mangler en positiv eller negativ ladning.
6. Afstem oxygenatomerne ved at tilføje det korrekte antal vandmolekyler på den side, hvor der mangler oxygen.
7. Kontrollér, at antallet af hydrogenatomer er ens på begge sider af reaktionspilen.
Afstemningsregler
1. Skriv reaktionsskemaet med reaktanter, produkter og tilstandsformer men uden koefficienter.
2. Bestem OT for de atomer, der ændrer oxidationstal.
3. Afstem antallet af afgivne og optagne elektroner.
a. Den samlede stigning i OT (antal afgivne elektroner) skal svare til det samlede fald i OT (antal af optagne elektroner). Dette justeres med at sætte koefficienter foran reaktanter og produkter.
4. Kontrollér, at antallet af ens atomer er det samme på begge sider af reaktionspilen bortset fra hydrogen og oxygen.
5. Afstem ladning på begge sider af reaktionspilen.
a. I sur opløsning afstemmes med hydroner, H+.
b. I basisk opløsning afstemmes med hydroxid, OH–.
c. I neutral opløsning afstemmes enten med hydroner eller hydroxid på produktsiden af reaktionen, afhængig af, om der mangler en positiv eller negativ ladning.
6. Afstem oxygenatomerne ved at tilføje det korrekte antal vandmolekyler på den side, hvor der mangler oxygen.
7. Kontrollér, at antallet af hydrogenatomer er ens på begge sider af reaktionspilen.
Se mere
Hvis det stemmer, er du i mål og har afstemt din reaktion korrekt. I eksempel 6 gennemgås, hvordan man bruger afstemningsreglerne trin for trin.
Eksempel 6
I denne video lavet af Gymnasiekemi ser du, hvordan du systematisk kan afstemme redoxreaktioner i surt og basisk miljø.
Nedenfor følger et eksempel på afstemning i neutralt miljø, hvordan du kan følge listen over reglerne for afstemning af redoxreaktioner punkt for punkt:
Når thiosulfat reagerer med dichlor og danner sulfat og chlorid, sker det i et neutralt miljø.
1. Skriv reaktionsskemaet med reaktanter, produkter og tilstandsformer men uden koefficienter.
| S2O32-(aq) + Cl2(g) → SO42-(aq) + Cl–(aq) | (20a) |
2. Bestem OT for de atomer, der ændrer oxidationstal.
|
+II 0 +VI -I S2O32-(aq) + Cl2(g) → SO42-(aq) + Cl–(aq) |
(20b) |
3. Afstem antallet af afgivne og optagne elektroner.
a. Den samlede stigning i OT (antal afgivne elektroner) skal svare til det samlede fald i OT (antal af optagne elektroner). Dette justeres med at sætte koefficienter foran reaktanter og produkter.
Svovl stiger i OT fra +II til +VI, og derfor bliver svovl oxideret. Chlor falder i OT fra 0 til -I og reduceres derfor. Det kan du skrive på denne måde:
![]()
For at den samlede stigning i OT og det samlede fald i OT er ens, skal du sætte koefficienter foran, så der er 1 svovlatom, der stiger med 4, og 4 chloratomer, der hver falder med 1. De blå tal viser antallet af atomer, der ændrer OT. Det kan du skrive på denne måde:
![]()
Koefficienter burde nu kunne sættes direkte ind i reaktionsskemaet. Dog skal du holde tungen lige i munden, for der er allerede 2 svovlatomer på reaktantsiden, og derfor skal der selvfølgelig også være 2 på produktsiden. Dermed ender du med at have 2 svovlatomer, der hver stiger med 4 og altså en samlet stigning på 8. Dermed skal det samlede fald i OT også være 8. Så du skal gange antallet af atomer, der ændrer OT, med 2, så passer det.
![]()
Nu kan du sætte passende koefficienter foran reaktanter og produkter.
| S2O32-(aq) + 4 Cl2(g) → 2 SO42-(aq) + 8 Cl–(aq) | (20b) |
4. Kontrollér, at antallet og typen af atomer er ens på begge sider af reaktionspilen bortset fra hydrogen og oxygen.
Der er 2 svovlatomer i thiosulfat (S2O32-) på reaktantsiden, og der er 1 svovlatom i sulfat (SO42-) på produktsiden, og dem er der 2 af (2 SO42-).
Der er 2 chloratomer i dichlor (Cl2) på reaktantsiden, og dem er der 4 af (4 Cl2), og der er 1 chloratom i chlorid (Cl–) på produktsiden, og dem er der 8 af (8 Cl–).
5. Afstem ladning på begge sider af reaktionspilen.
a. I sur opløsning afstemmes med hydroner, H+.
b. I basisk opløsning afstemmes med hydroxid, OH–.
c. I neutral opløsning afstemmes enten med hydroner eller hydroxid på produktsiden af reaktionen, afhængig af, om der mangler en positiv eller negativ ladning.
Ladningen afstemmes nu ved at bruge det skema, som du så i Gymnasiekemi-videoen, og derfor skal du tælle ladningerne på hver side. Du kan med fordel bruge et skema som vist nedenfor, hvor V står for venstre side af reaktionen (reaktantsiden), og H står for højre side af reaktionen (produktsiden).
På venstre side er der 1 thiosulfat, som har ladningen -2. Dichlor har ingen ladning, så ladningen på venstre side er -2. Det skrives ind i skemaet.
På højre side er der 2 sulfat, som har en ladning på -2. Der er 8 chlorid, og ionen har en ladning på -1. Dermed er der en samlet ladning på højre side på -4 – 8 = -12.
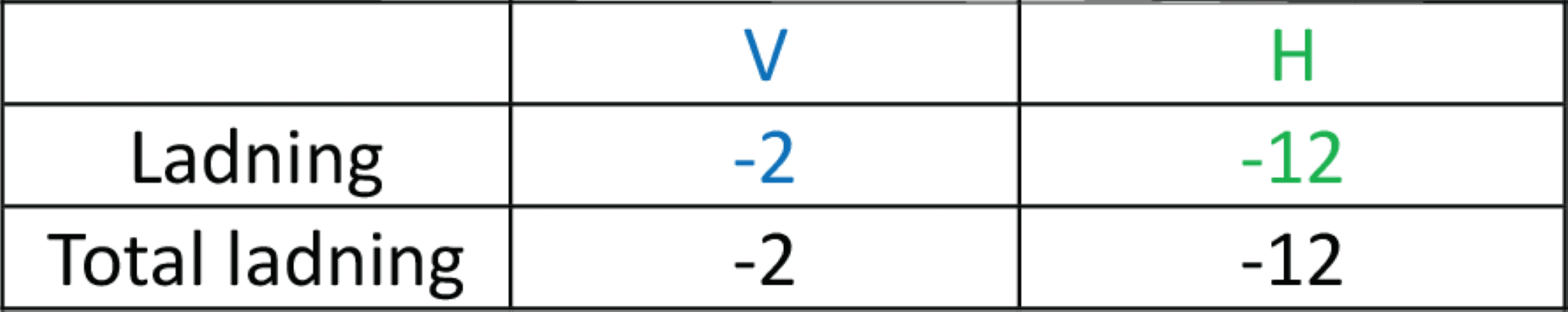
Da ladningen skal være ens på begge sider af reaktionspilen, skal du nu bruge oplysningen om, hvorvidt reaktionen sker i en opløsning, der fra starten af reaktionen er sur, basisk eller neutral. I dette tilfælde er det i en neutral opløsning. Dermed skal du afgøre, om du skal afstemme med positive hydroner eller negative hydroxidioner på højre side, så ladningen på højre side svarer til den på venstre side, som er -2. Der skal tilføjes 10 positive hydroner på venstre side. Det kan du angive i skemaet.
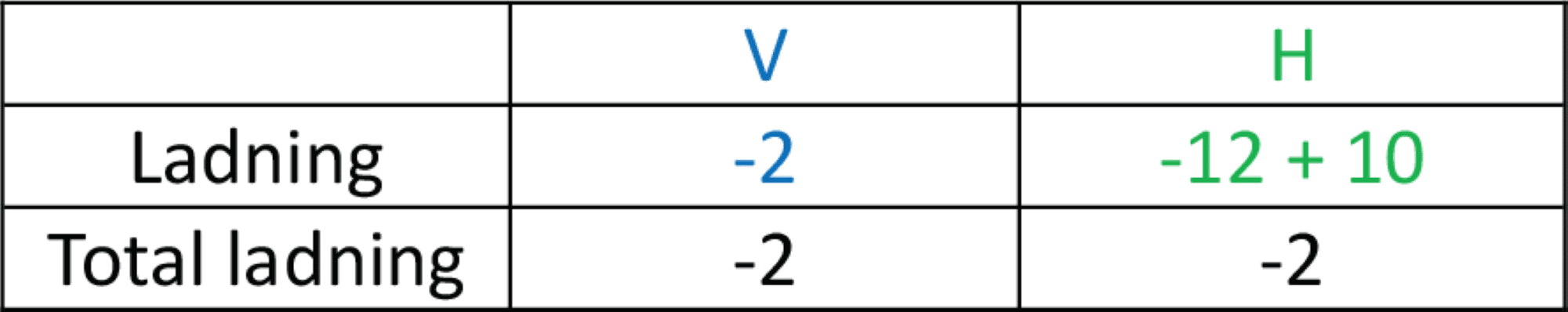
10 hydroner indsættes i reaktionsskemaet på højre side af reaktionspilen.
| S2O32-(aq) + 4 Cl2(g) → 2 SO42-(aq) + 8 Cl–(aq) + 10 H+(aq) | (20d) |
6. Afstem oxygenatomerne ved at tilføje det korrekte antal vandmolekyler på den side, hvor der mangler oxygen.
Antallet af oxygenatomer afstemmes ved at bruge det skema, som du så i Gymnasiekemi-videoen, og her skal du tælle dem på hver side. Du kan med fordel bruge et skema som vist nedenfor, hvor V står for venstre side af reaktionen (reaktantsiden), og H står for højre side af reaktionen (produktsiden).
Der er 3 oxygenatomer i thiosulfat (S2O32-) på venstre side og ingen i dichlor, og dermed er der i alt 3 oxygenatomer på reaktantsiden. I sulfat (SO42-) er der 4 oxygenatomer på højre side, og dem er der 2 af. Dermed er der i alt 8 oxygenatomer på produktsiden.
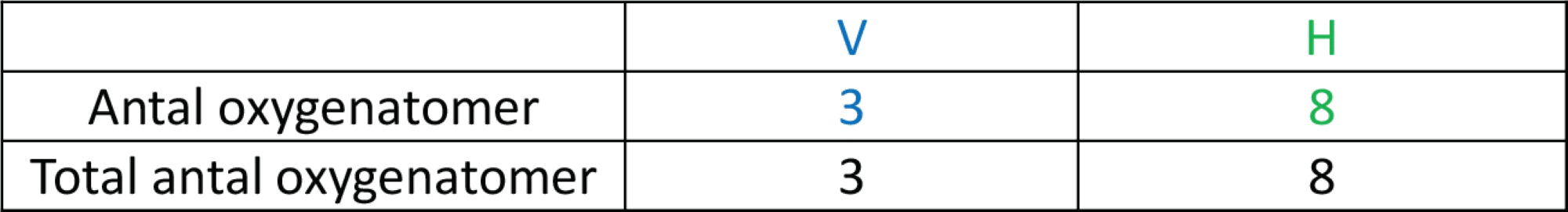
Der mangler 5 oxygenatomer på venstre side, og de tilføjes ved at skrive 5 vandmolekyler på venstres side i reaktionsskemaet.
| 5 H2O(l) + S2O32-(aq) + 4 Cl2(g) → 2 SO42-(aq) + 8 Cl–(aq) + 10 H+(aq) | (20e) |
7. Kontrollér, at antallet af hydrogenatomer er ens på begge sider af reaktionspilen.
Præcis som ovenfor tæller du antallet af hydrogenatomer. På venstre side er der 2 hydrogenatomer i hvert af de 5 vandmolekyler, og dermed er der 10 hydrogenatomer. På højre side er der 10 hydroner, og dermed passer antallet af hydrogenatomer.
Eksempel 6
I denne video lavet af Gymnasiekemi ser du, hvordan du systematisk kan afstemme redoxreaktioner i surt og basisk miljø.
Nedenfor følger et eksempel på afstemning i neutralt miljø, hvordan du kan følge listen over reglerne for afstemning af redoxreaktioner punkt for punkt:
Når thiosulfat reagerer med dichlor og danner sulfat og chlorid, sker det i et neutralt miljø.
1. Skriv reaktionsskemaet med reaktanter, produkter og tilstandsformer men uden koefficienter.
| S2O32-(aq) + Cl2(g) → SO42-(aq) + Cl–(aq) | (20a) |
2. Bestem OT for de atomer, der ændrer oxidationstal.
|
+II 0 +VI -I S2O32-(aq) + Cl2(g) → SO42-(aq) + Cl–(aq) |
(20b) |
3. Afstem antallet af afgivne og optagne elektroner.
a. Den samlede stigning i OT (antal afgivne elektroner) skal svare til det samlede fald i OT (antal af optagne elektroner). Dette justeres med at sætte koefficienter foran reaktanter og produkter.
Svovl stiger i OT fra +II til +VI, og derfor bliver svovl oxideret. Chlor falder i OT fra 0 til -I og reduceres derfor. Det kan du skrive på denne måde:
![]()
For at den samlede stigning i OT og det samlede fald i OT er ens, skal du sætte koefficienter foran, så der er 1 svovlatom, der stiger med 4, og 4 chloratomer, der hver falder med 1. De blå tal viser antallet af atomer, der ændrer OT. Det kan du skrive på denne måde:
![]()
Koefficienter burde nu kunne sættes direkte ind i reaktionsskemaet. Dog skal du holde tungen lige i munden, for der er allerede 2 svovlatomer på reaktantsiden, og derfor skal der selvfølgelig også være 2 på produktsiden. Dermed ender du med at have 2 svovlatomer, der hver stiger med 4 og altså en samlet stigning på 8. Dermed skal det samlede fald i OT også være 8. Så du skal gange antallet af atomer, der ændrer OT, med 2, så passer det.
![]()
Nu kan du sætte passende koefficienter foran reaktanter og produkter.
| S2O32-(aq) + 4 Cl2(g) → 2 SO42-(aq) + 8 Cl–(aq) | (20b) |
4. Kontrollér, at antallet og typen af atomer er ens på begge sider af reaktionspilen bortset fra hydrogen og oxygen.
Der er 2 svovlatomer i thiosulfat (S2O32-) på reaktantsiden, og der er 1 svovlatom i sulfat (SO42-) på produktsiden, og dem er der 2 af (2 SO42-).
Der er 2 chloratomer i dichlor (Cl2) på reaktantsiden, og dem er der 4 af (4 Cl2), og der er 1 chloratom i chlorid (Cl–) på produktsiden, og dem er der 8 af (8 Cl–).
5. Afstem ladning på begge sider af reaktionspilen.
a. I sur opløsning afstemmes med hydroner, H+.
b. I basisk opløsning afstemmes med hydroxid, OH–.
c. I neutral opløsning afstemmes enten med hydroner eller hydroxid på produktsiden af reaktionen, afhængig af, om der mangler en positiv eller negativ ladning.
Ladningen afstemmes nu ved at bruge det skema, som du så i Gymnasiekemi-videoen, og derfor skal du tælle ladningerne på hver side. Du kan med fordel bruge et skema som vist nedenfor, hvor V står for venstre side af reaktionen (reaktantsiden), og H står for højre side af reaktionen (produktsiden).
På venstre side er der 1 thiosulfat, som har ladningen -2. Dichlor har ingen ladning, så ladningen på venstre side er -2. Det skrives ind i skemaet.
På højre side er der 2 sulfat, som har en ladning på -2. Der er 8 chlorid, og ionen har en ladning på -1. Dermed er der en samlet ladning på højre side på -4 – 8 = -12.

Da ladningen skal være ens på begge sider af reaktionspilen, skal du nu bruge oplysningen om, hvorvidt reaktionen sker i en opløsning, der fra starten af reaktionen er sur, basisk eller neutral. I dette tilfælde er det i en neutral opløsning. Dermed skal du afgøre, om du skal afstemme med positive hydroner eller negative hydroxidioner på højre side, så ladningen på højre side svarer til den på venstre side, som er -2. Der skal tilføjes 10 positive hydroner på venstre side. Det kan du angive i skemaet.

10 hydroner indsættes i reaktionsskemaet på højre side af reaktionspilen.
| S2O32-(aq) + 4 Cl2(g) → 2 SO42-(aq) + 8 Cl–(aq) + 10 H+(aq) | (20d) |
6. Afstem oxygenatomerne ved at tilføje det korrekte antal vandmolekyler på den side, hvor der mangler oxygen.
Antallet af oxygenatomer afstemmes ved at bruge det skema, som du så i Gymnasiekemi-videoen, og her skal du tælle dem på hver side. Du kan med fordel bruge et skema som vist nedenfor, hvor V står for venstre side af reaktionen (reaktantsiden), og H står for højre side af reaktionen (produktsiden).
Der er 3 oxygenatomer i thiosulfat (S2O32-) på venstre side og ingen i dichlor, og dermed er der i alt 3 oxygenatomer på reaktantsiden. I sulfat (SO42-) er der 4 oxygenatomer på højre side, og dem er der 2 af. Dermed er der i alt 8 oxygenatomer på produktsiden.

Der mangler 5 oxygenatomer på venstre side, og de tilføjes ved at skrive 5 vandmolekyler på venstres side i reaktionsskemaet.
| 5 H2O(l) + S2O32-(aq) + 4 Cl2(g) → 2 SO42-(aq) + 8 Cl–(aq) + 10 H+(aq) | (20e) |
7. Kontrollér, at antallet af hydrogenatomer er ens på begge sider af reaktionspilen.
Præcis som ovenfor tæller du antallet af hydrogenatomer. På venstre side er der 2 hydrogenatomer i hvert af de 5 vandmolekyler, og dermed er der 10 hydrogenatomer. På højre side er der 10 hydroner, og dermed passer antallet af hydrogenatomer.
Se mere
Når antallet af hydrogenatomer er ens på begge sider af reaktionspilen, har du afstemt dit reaktionsskema korrekt. Hvis du oplever, at det ikke stemmer, må du på jagt efter fejlen.
Iodid og iodat reagerer i sur opløsning og danner diiod. Du skal afstemme reaktionsskema (21) ved at bruge afstemningsreglerne.
| I–(aq) + IO3–(aq) → I2(aq) | (21) |
Når du skal finde koefficienterne, kan det være en hjælp at skrive op, hvordan iodatomer fra iodid og iodatomer fra iodat ændrer OT som i punkt 3 i eksempel 6, hvor det er vist for to forskellige atomer (svovl og chlor).
Se mere
Nu skal du møde lidt hverdagskemi. Hypochlorit findes i mange produkter til toiletrens, da det har en desinficerende egenskab. Det har dog ingen effekt på kalkaflejringer i toilettet (se figur 12), og derfor hælder flere mennesker også syre ned i toilettet for at opløse kalken. Og det er et problem! Det får du forklaringen på, når du har løst den næste opgave om redoxreaktioner.
En typisk syre, man vil bruge til at afkalke sit toilet med, er ethansyre (eddikesyre) eller citronsyre, der er svage syrer. Når hypochlorit (ClO–) fra toiletrens reagerer med en af disse syrer, dannes dichlor gennem en række kemiske reaktioner. Hvis man i stedet bruger saltsyre, dannes dichlor direkte. Du skal nu prøve at afstemme denne redoxreaktion. Reaktanterne er hypochlorit og chlorid (fra saltsyren), og produktet er dichlor. Brug afstemningsreglerne.
Se mere
Hvad har en tur i svømmehallen med krigsgas fra 1. verdenskrig at gøre?
Det er heldigvis harmløst at tage en tur i svømmehallen (figur 13) eller bade i poolen på en ferie. Men du har nok bemærket, at der lugter lidt. Man siger ofte, at der lugter af chlor. Og det er rigtigt nok. Eller som kemiker vil det være mere korrekt at sige, at der lugter af dichlor. Der skal ganske lidt til af denne gas, før vi kan lugte den.

For at vandet i svømmehaller ikke bliver fyldt med bakterier og snavs, renses vandet med bl.a. natriumhypochlorit, og pH justeres til lidt over 7. I de offentlige svømmehaller kontrolleres vandkvaliteten meget nøje, og der tilsættes syre og hypochlorit, hvis målingerne ikke passer med standarderne. I daglig tale siger man, at der tilsættes ”klor”, men det er i form af natriumhypochlorit.
Når du og andre befinder jer i vandet i svømmehallen, ryger der lidt hår, hudceller og andet snavs i form af organisk materiale af. Der er også bakterier og svampe, som ryger af kroppen. Gennem en række kemiske reaktioner binder chloratomerne sig til det organiske materiale, og man kalder det herefter for ”bundet klor”. Det hypochlorit, som ikke har reageret, kaldes for ”frit klor” og er altså i stand til fortsat at holde vandet rent. Men hvis folk i svømmehallen ikke vasker sig grundigt nok, så er det ‘Tilbage under bruseren’, for ellers får det betydning for mængden af ”frit klor”, og det kan blive nødvendigt at tilsætte mere natriumhypochlorit.
Hvis du har løst opgave 10 ovenfor, har du opdaget, at når hypochlorit og syre blandes, dannes dichlor, der som nævnt er en giftig gas, hvis man ikke følger procedurerne for rensning og vedligehold af vandet korrekt. Det har man heldigvis styr på i de offentlige svømmehaller, men man kan ikke sikre sig mod uforudsete uheld, som det skete i en svømmehal i Hvidovre i 2019, hvor 11 personer blev kørt på skadestuen. De oplevede åndedrætsbesvær, men kom sig heldigvis hurtigt.
Når dichlor indåndes, og det kommer ned i lungerne, reagerer det med den smule vævsvæske, som ligger på indersiden af lungerne. Der kan opløses meget dichlor i vand (se reaktion 22), hvorved der dannes hypochloritsyre (HClO) og den stærke syre, saltsyre (HCl, se reaktion 23). Hypochloritsyren i lungerne reagerer videre og danner oxonium (H3O+) og hypochloritsyres korresponderende base, hypochlorit (OCl–, se reaktion 24). De stærke syrer, saltsyre og oxonium, neutraliseres af kroppens puffersystemer, men dichlor, hypochloritsyre og hypochlorit angriber aminogrupper i molekylerne i lungernes væv og ødelægger det. Hvor store ødelæggelser, der sker i lungerne, afhænger af, hvor høj koncentrationen af dichlor, man indånder.
| Cl2(g) ⇌ Cl2(aq) | (22) |
| Cl2(aq) + H2O(l) ⇌ HCl(aq) + HClO(aq) | (23) |
| HClO(aq) + H2O(l) ⇌ H3O+(aq) + OCl–(aq) | (24) |
Alle reaktionerne er kemiske ligevægte, som du enten allerede har mødt eller møder snart i et andet tema på b-niveau i kemi. Det betyder blot, at reaktionen kan forløbe i begge retninger.
Åndedrættet hos de påvirkede personer i svømmehallen blev irriteret, men koncentrationen af dichlor var ikke høj nok til, at det blev livstruende.
Det forholdt sig til gengæld anderledes under 1. verdenskrig, hvor dichlor blev brugt som verdenshistoriens første masseødelæggelsesvåben. En del af krigen mellem bl.a. Tyskland på den ene side og Frankrig, England og USA på den anden side foregik som skyttegravskrig, hvor soldaterne på begge sider stod i dybe huller og gange i jorden og bekæmpede hinanden. I 1915 havde tyskerne udviklet teknologien til at bruge dichlor som krigsgas. Gassen er tungere end luften, den er gulgrøn og giftig. Tyskerne sendte gassen mod fjenden, som sad nede i skyttegravene, og den gulgrønne gas, som endte dernede, dræbte fjenden. Hvis vinden vendte, dræbte gassen også ens egne soldater, hvilket er en vigtig grund til, at man hurtigt holdt med at bruge chlorgas.

Sikkerhedsleder på Institut for Kemi på Aarhus Universitet, Peter Hald, holder ind imellem foredrag om netop masseødelæggelsesvåben. Han fortæller, at der som i al krigsførelse er utrolig meget logistik, der skal klappe, for at man har succes. Peter udtaler ”Det må have været et logistisk helvede at bruge dichlor som krigsgas!” For at få koncentrationen af dichlor høj nok i fri luft, skulle der bruges meget gas, som kom i store trykluftsflasker.
Peter udtaler videre: ”Under det andet slag ved Ypres (april 1915) blev der brugt 5730 gasflasker med flydende dichlor. De tungeste af flaskerne vejede 40 kilo, så der skulle to soldater til at fragte dem. Trykluftsflaskerne skulle herefter placeres med en afstand til hinanden, så der ikke ville opstå ”huller” i giftgassen, og de skulle alle åbnes på samme tid! Og så skulle tyskerne være sikre på, at vinden blæste gassen den rigtige vej og ikke pludselig vendte, så gassen ramte dem selv! Det skete desværre for briterne ca. et halvt år senere!”

Mange soldater døde under det første giftgasangreb, men det første simple beskyttelsesudstyr blev hurtigt taget i brug herefter. Det var faktisk bare et vådt lommetørklæde foran næse og mund, fordi opløseligheden af gassen i vand er så stor! Og var der ikke vand til rådighed, urinerede soldaterne på et stykke stof og holdt det op foran næse og mund!

Læs om det første giftgasangreb og øjenvidneberetninger fra stedet her.
Se mere
1. Læs faktaboksen ”Svømmehaller og krigsgas”.
2. Skriv en forklaring til din lærer med reaktionsskemaer, hvor du begrunder, hvorfor det er uhensigtsmæssigt at blande toiletrens og syre.
3. Skriv herefter en forklaring til klassens forældre, som ikke har en kemisk baggrund, hvor du forklarer det samme.
Se mere
Forbrugerrådet ‘Tænk’ arbejder generelt for, at vi som forbrugere i Danmark kan foretage trygge valg af fx produkter, så de ikke er skadelige for os, vores nærmeste og miljøet. De har bl.a. testet forskellige mærker af toiletrens, og et lille udsnit af det, de skriver, kan du læse i figur 16.

1. Diskutér i mindre grupper, hvorfor indholdet i udklippet ikke er kemisk korrekt.
2. Forsøg at skrive en alternativ overskrift og tekst, der rammer den brede befolkning samtidig med, at I ikke går på kompromis med kemien.
Se mere
I faktaboksen ‘Svømmehaller og krigsgas’ finder du 3 reaktionsskemaer. Undersøg et ad gangen og argumentér for, om der er tale om en redoxreaktion eller ej.
Se mere
4 Hvordan kan man bestemme manganindholdet i batterier med redoxkemi?
Nu er du ved at være klædt godt på med viden om redoxkemi, og det skal du bruge i forsøget om grundstoffet mangans mange oxidationstal også kaldt ’Den kemiske ka. Længere nede kan du se, hvordan man kan bygge sit eget genopladelige batteri på Institut for Kemi på Aarhus Universitet, eller du kan måske besøge instituttet med din klasse og prøve det selv. Og så skal du møde flere andre batteriforskere i Danmark – hver med sit fokus på at udvikle fremtidens batterier.
Mangan er grundstof nummer 25 og er et overgangsmetal, der hører til i undergrupperne. Det er et meget brugt grundstof i de klassiske alkaliske brunstensbatterier og i lithiumionbatterier. Du kan læse mere om brunstensbatterier her. I linket kan du bl.a. læse, at katoden i brunstensbatterier netop indeholder brunsten, som er en manganforbindelse.
I brunstensbatterier sker følgende redoxreaktion:
| Zn(s) + 2MnO2(s) → ZnO(s) + Mn2O3(s) | (25) |
1. Argumentér for, at der er tale om en redoxreaktion.
2. Bestem OT for mangan i de to manganforbindelser.
Se mere
Mangan spiller altså en direkte rolle i redoxreaktion i brunstensbatterier, men i lithiumionbatterierne har grundstoffet en anden rolle. Her øger mangans tilstedeværelse batteriets spænding, kapacitet og stabilitet. Og da mangan er et forholdsvist hyppigt forekommende grundstof, er der også miljømæssige fordele ved at bruge dette fremfor fx kobolt.
I opgave 14 fandt du ud af hvilke OT, mangan havde i de to forbindelser i reaktion (25). Mangan kan have flere andre OT, og mangan har i hvert af disse OT forskellige farver, som du kan se i figur 16.
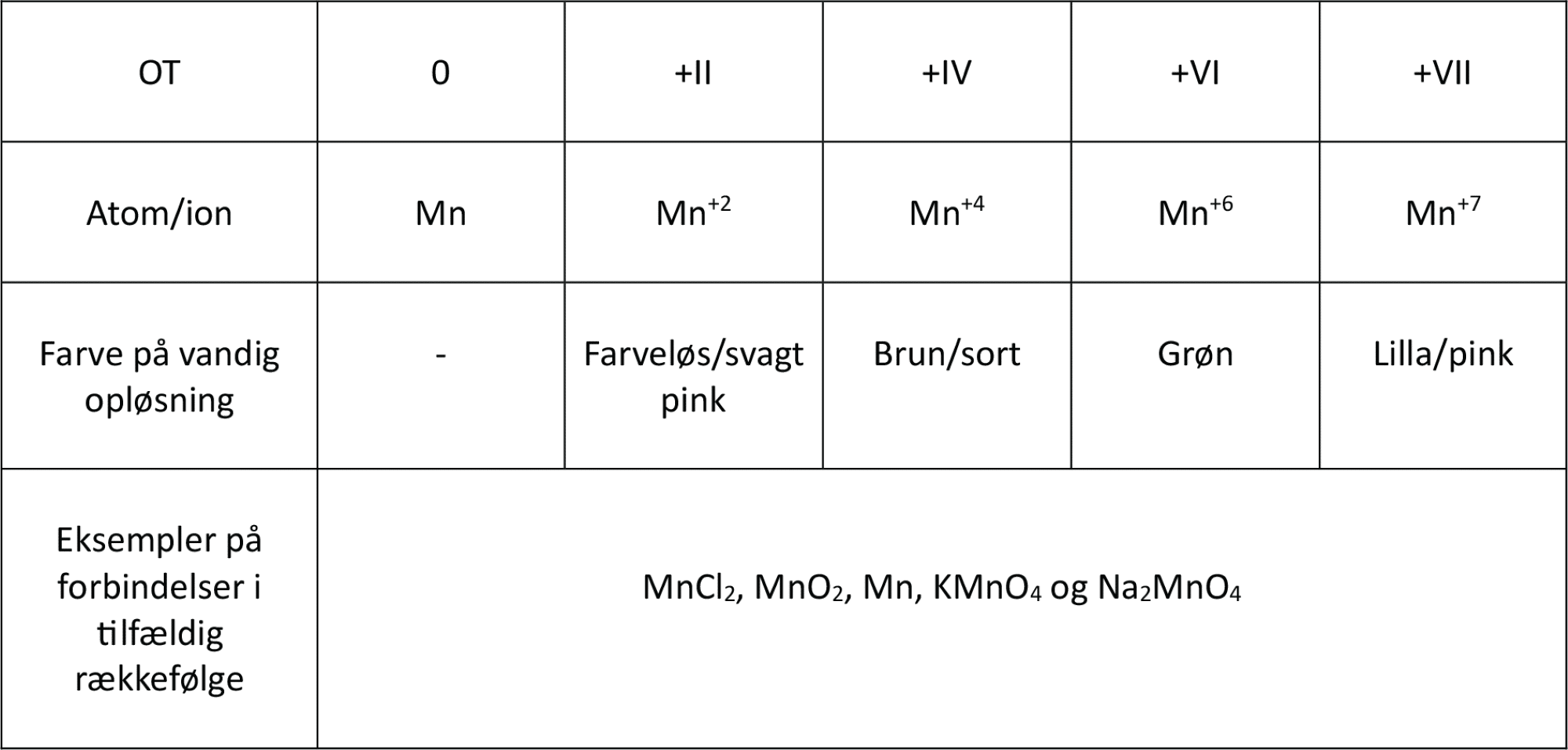
I figur 17 er der angivet følgende stoffer med mangan: MnCl2, MnO2, Mn, KMnO4 og Na2MnO4. De er hver især eksempler på mangan med OT på 0, +II, +IV, +VI og +VII. Hvilke stoffer er eksempler på hvilke OT for mangan?
Se mere
I ’Forsøg 3: Den kemiske kamelæon’ vil du møde de mest almindelige farver og dermed de mest almindelige OT, som mangan kan have.
kamelæoners hud skifter farve pga. strukturen af nanokrystaller i huden? Strukturen af disse ændrer sig, når krystallerne trækkes fra hinanden, og dermed ændrer farven på huden sig også. Kemikere, bl.a. materialekemikere, som du møder et par stykker af længere nede (link), forsøger at efterligne kamelæonernes farveskift. De forestiller sig, at teknologien fx kan bruges til at identificere slidte områder på flyvinger, da de vil have en anden farve.

Mangans mange farveskift har givet grundstoffet øgenavnet ’den kemiske kamelæon’. Du skal i forsøget undersøge mangans farver og de redoxreaktioner, der kobles hertil.

(Du skal scrolle lidt ned på siden, du kommer ind på.)
Bilbatterier af typen NMC 622 indeholder udover lithium også nikkel, mangan og cobalt. Selve batteriet uden indpakning vejer 350 kg, og manganindholdet er på 20% i katoden.
Du skal beregne stofmængden af mangan i et NMC 622 bilbatteri, under antagelse af, at katoden udgør halvdelen af hele batteriets masse.
Se mere
I NMC 622 har mangan et OT på +IV. Du skal i ‘Forsøg 4: Mangan i elbilbatterier’ bruge din viden om mangans farver og oxidationstal til at identificere en metode til at fremstille mangan til et bilbatteri og regne på, om metoden er smart.
Vha. en video skal du identificere de forsøgsbetingelser, du skal bruge i forsøget. Herefter skal du beregne den masse af mangan, du ville skulle fremstille for at have nok til et elbilbatteri.

(Du skal scrolle lidt ned på siden, du kommer ind på.)
Du har nu fået indblik i, hvordan man kan bruge redoxkemi til at undersøge og fremstille forskellige manganforbindelser. Denne viden kan også bruges om andre metaller og er fundamental i udviklingen af moderne batterier. I det næste afsnit kan du se, hvordan danske forskere arbejder med at omsætte kemi til nye batteriteknologier.
5 Hvad arbejder batteriforskerne i Danmark med?
Mangel på energi topper listen af menneskelige udfordringer i en foranderlig verden. Hvis vi kan løse denne udfordring, kan vi løse mange andre udfordringer ifølge professor Jan Rossmeisl fra Kemisk Institut på Københavns Universitet.
Men hvor skal energien komme fra? Hvordan vurderer vi, hvor god en energikilde er? Og hvilke energiformer kan vi få mest energi ud af i forhold til, hvor meget energi der går tabt undervejs fra produktion og transport til forbrug? Her spiller kemien en afgørende rolle. Med kemien kan vi beskrive og sammenligne energiindhold og energieffektivitet for fx benzin, kul, batterier og dihydrogen. Det skal du lære mere om i det følgende afsnit.
Hvis du har brug for at få genopfrisket, hvordan et batteri er opbygget og fungerer, kan du med fordel læse her.
For at forstå, hvad der menes med energiindhold og energieffektivitet, kan vi kigge på biologiens verden (se figur 18).

Elefanter bruger 16 timer i døgnet på at spise græs og blade. De kan indtage mere end 100 kg føde på den tid. Omvendt indtager en løve kun 20-40 kg kød, når den har nedlagt et bytte. Herefter sover og slapper den af i dagevis, før det er nødvendigt at spise igen. Denne forskel skyldes forskelle i både energiindhold og energieffektivitet, og de er meget vigtige begreber for at vurdere hvor god en energikilde er. Lad os se nærmere på elefanten og løven fødeindtag.
Energiindholdet beskriver hvor eget energi, der er i et materiale. Den kemiske energi i en fødevare skyldes, at der frigøres energi når de kemiske bindinger brydes under forbrænding af molekyler. Hvis du sammenligner 1 kg græs og 1 kg kød, vil der være mere energi i kødet. Dvs. energiindholdet er større i kødet end i græsset. Dette skyldes bl.a. at fedtindholdet er højere i kød, og at vandindholdet i græs er højere. Da 1 kg græs fylder meget mere end 1 kg kød, gælder det også, at energiindholdet målt pr. liter er højere for kødet end græsset.
Energieffektiviteten siger noget om, hvor godt energien i et stof udnyttes. En elefant og en løve udnytter energien i hver deres føde forskelligt, og derfor er energieffektiviteten for græs og kød også forskellig. En elefant skal spise over 100 kg græs og blade om dagen, og den udnytter faktisk kun 50% af det den spiser. Resten kommer stort set ufordøjet ud. Omvendt udnytter rovdyr som løver 60-80% af energien i deres føde.
I figur 19 kan du se, hvor meget energi der er i forskellige energimaterialer som fossilt brændstof, batterier og grønne brændstoffer produceret fra Power-to-X-teknologien i forhold til, hvor meget de vejer og fylder. Jo højere energiindhold, der er i 1 kg energimateriale, og jo højere energiindhold, der er i 1 L energimateriale, jo bedre. Her er batterier langt fra lige så gode som fx benzin. Pga. de logaritmiske akser, er energiindholdet ca. 100 gange mindre. Men du skal samtidig også forholde dig til, hvor effektivt vi udnytter energien i energimaterialer, og her er batterier meget energieffektive. Du kan dog selv mærke, at energieffektiviteten for batterier ikke er 100 %. Når du bruger din mobiltelefon længe, kan du mærke, at temperaturen stiger lidt. Der er altså lidt af energien i batteriet i din mobiltelefon, der går tabt til omgivelserne i form af varme. Dette varmetab er dog væsentlig større for benzin og PtX-kemikalierne. Når du afbrænder dem, går en stor procentdel af energien tabt til omgivelserne.
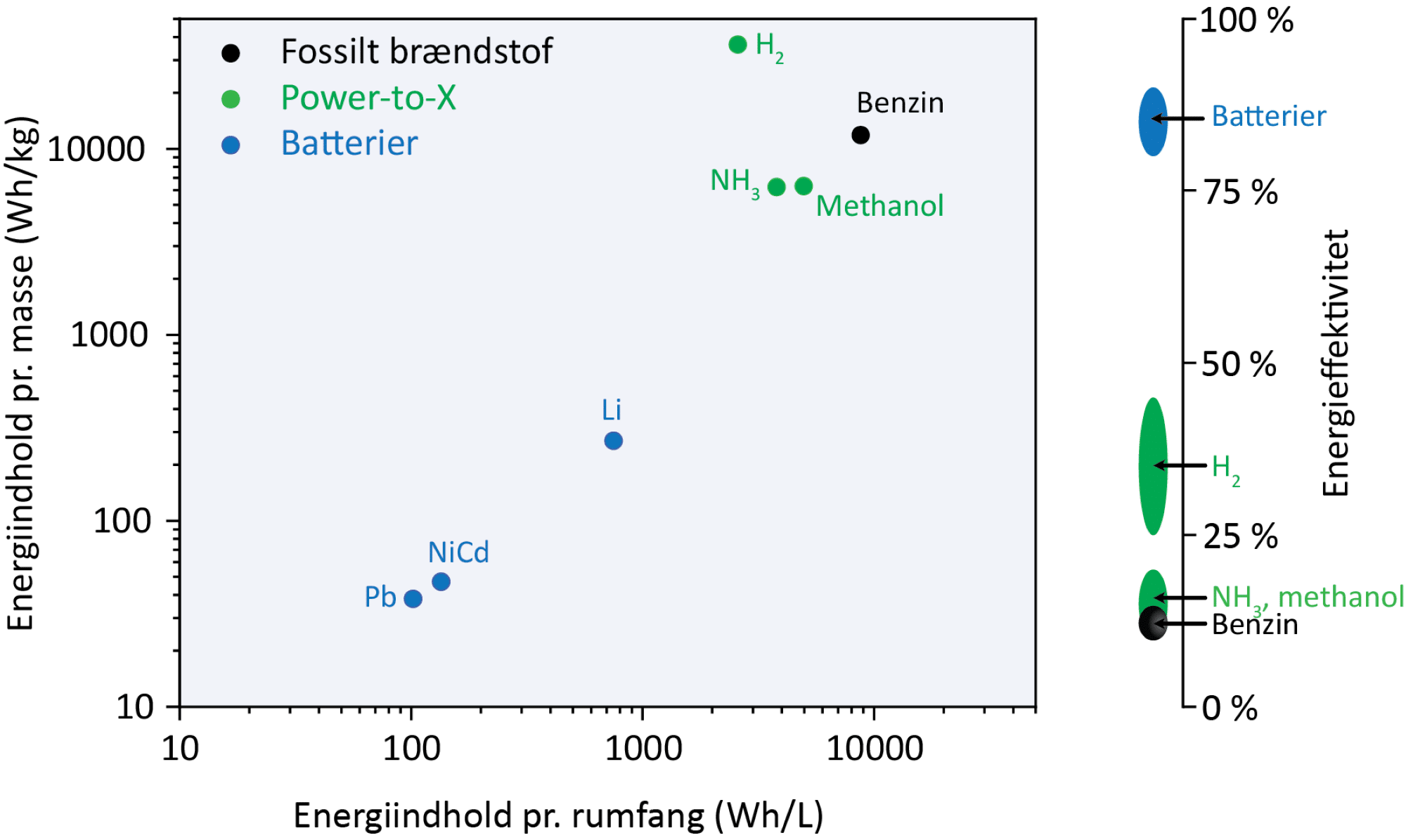
Når batteriforskere arbejder på at udvikle nye batterier, vil de gerne lave batterier med højt energiindhold pr. kg batteri, så batteriet nemt kan transporteres rundt. Samtidig er det vigtigt med en høj energieffektivitet, så næsten al energi i batteriet omdannes til elektrisk energi. Derudover skal grundstofferne være lettilgængelige, udvindes på en bæredygtig måde, og oxidationen af metalatomer til metalioner i anoden skal køre let. I figur 20 kan du se en oversigt over udvalgte anodemetaller, der er i spil indenfor batteriforskning. Jo lavere værdi standardreduktionspotentialet har, jo sværere har den viste reduktionsreaktion ved at foregå, men jo lettere foregår den modsatte reaktion. Det vil sige, at jo lavere værdi standardreduktionspotentialet har, jo lettere oxideres metallet til metalionen i anoden, og jo højere kan energiindholdet i batteriet blive.
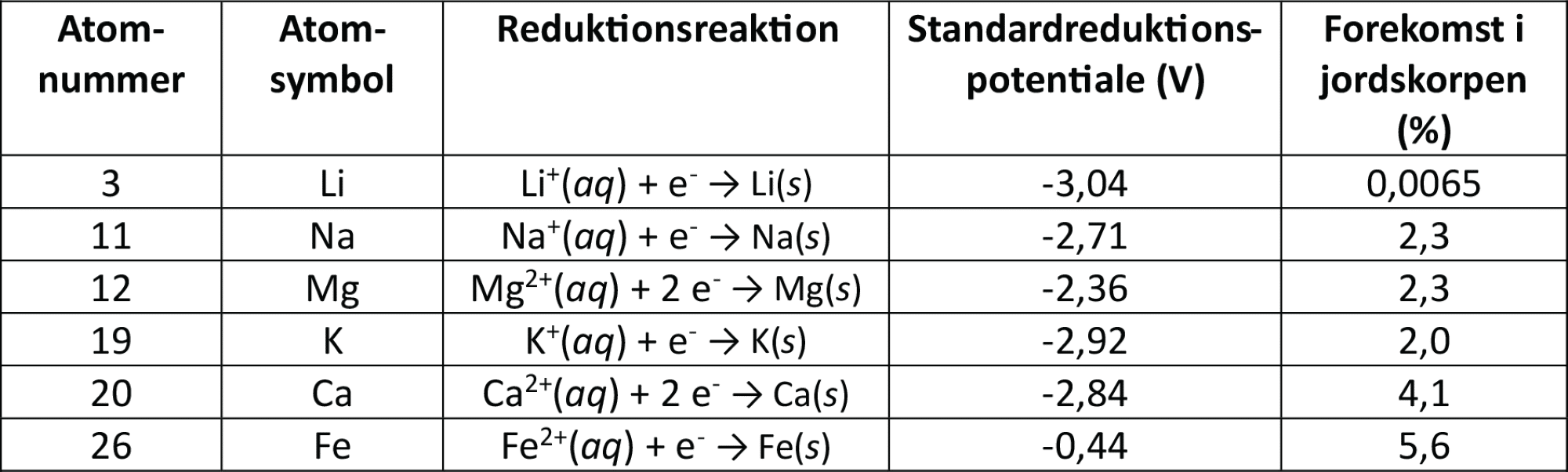
Forskning i at udvikle nye typer batterier er i fuld gang. Du har tidligere mødt Dorthe Ravnsbæk, der har flere projekter, der alle har målet at finde frem til batterier med høj kapacitet, lang holdbarhed (kan genoplades og aflades mange gange) og samtidig er bæredygtige. Fx undersøger hun muligheden for at erstatte lithium med magnesium. Du skal undersøge informationen i figur 20.
1. Hvad er godt, og hvad er skidt, hvis man vælger at satse på lithium i batterier, som er det, man allerede gør i en stor udstrækning?
2. Hvorfor undersøger Dorthe muligheden for at erstatte lithium med magnesium?
3. Er du enig med Dorthe, eller hvilket grundstof ville du satse på i stedet for lithium, og hvorfor? Begrund dit svar.
Se mere
Dorthe arbejder også på at forstå, hvorfor genopladelige lithiumionbatterier på et tidspunkt ikke længere kan genoplades. Man er langt med at forstå, at det delvist skyldes, at elektrolytten går i stykker, men noget af årsagen er også ændringer i strukturen i anoden og katoden, og dette forsøger hun netop at finde årsagerne til. Figur 21 viser, hvordan Dorthe bruger atomar røntgendiffraktion til at undersøge netop dette.
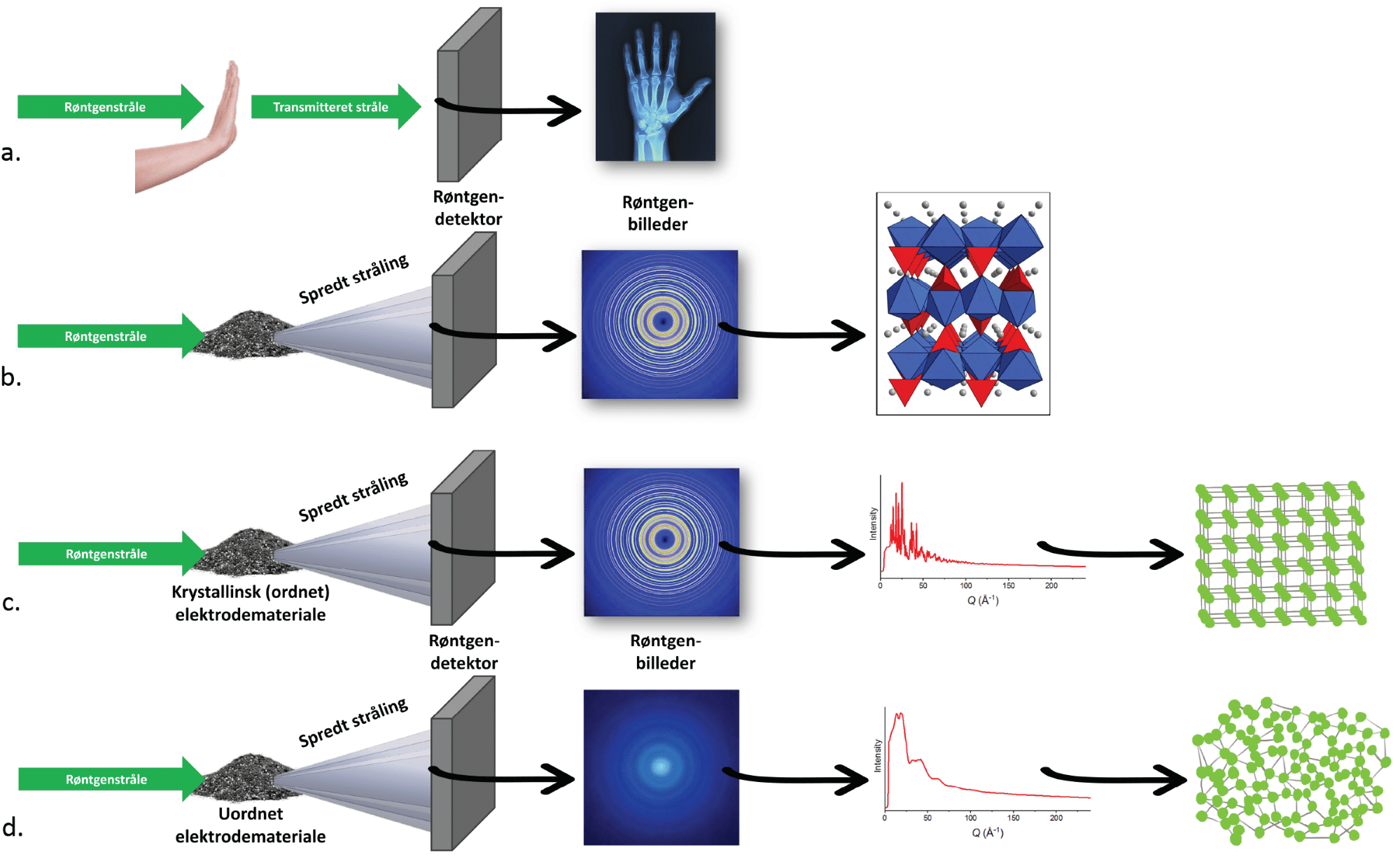
Kender man årsagen til, at krystalstrukturen går i stykker, kan man forsøge at forbedre det, så lithiumionbatterier kan genoplades endnu flere gange, end det allerede er tilfældet.
Faststofbatterier er et andet vigtigt forskningsområde i udviklingen af nye batterityper. I næste afsnit kan du læse mere om dette.
I et almindeligt genopladeligt lithiumionbatteri består elektrolytten, der adskiller anoden og katoden og kun tillader lithiumionen at passere, af en organisk væske, som er meget brændbar, og det udgør netop en risiko, da batteriet dermed er brandfarligt. Faststofbatterier er en type batteri, hvor den flydende elektrolyt er erstattet af et fast materiale, fx en keramisk eller polymerbaseret elektrolyt. Det gør batteriet mere sikkert, fordi der ikke er risiko for lækage eller brand som ved flydende elektrolytter. Både genopladelige cykelbatterier og bilbatterier har været årsag til flere brande, som du kan læse om her, og her kan du læse råd om, hvordan du undgår sådan en brand.
Ligesom professor Dorthe Ravnsbæk er Torben René Jensen, professor i kemi på Aarhus Universitet, også materialekemiker. En materialekemiker arbejder med at udvikle, undersøge og forbedre både naturlige og syntetiske materialer med særligt fokus på deres kemiske sammensætning og egenskaber. Målet er at designe materialer, der kan bruges i alt fra batterier og vindmøller til medicinsk udstyr og mobiltelefoner.
Hvordan kan man få faststofbatterier til at virke ved stuetemperatur?
Professor Torben R. Jensen arbejder med faststofbatterier, og han argumenterer her for at udvikle nye typer batterier:
’Lithiumionbatterier er efterhånden blevet optimeret på stort set alle parametre, så der skal udvikles helt nye typer batterier, hvis vi vil forøge energiindholdet yderligere. Fx nogen som ikke så let bryder i brand.’

Fordelene ved nye typer af faststofbatterier er, at de kan have en længere levetid, et højere energiindhold, og at det er muligt at anvende en anode af metal. Dette kan ikke lade sig gøre, når elektrolytten er en organisk væske, da der kan dannes nåleformede krystaller ved langvarig brug, og dermed kortslutter batterierne. Udfordringerne er, at fordi elektrolytten er fast, så binder metalioner, fx Li+ eller Mg2+, sig stærkere til omgivelserne og bevæger sig langsommere end i en væske.
Torben arbejder specifikt med at udvikle nye materialer til elektrolytter i faststofbatterier. Han undersøger forskellige sammensætninger af såkaldte borhydrider. Det er boratomer, der er omgivet af hydrogenatomer. Et af de nye, uorganiske materialer, han kigger på, har den kemiske formel Mg(BH4)2∙NH3. I figur 22 kan du se opbygningen af denne elektrolyt.
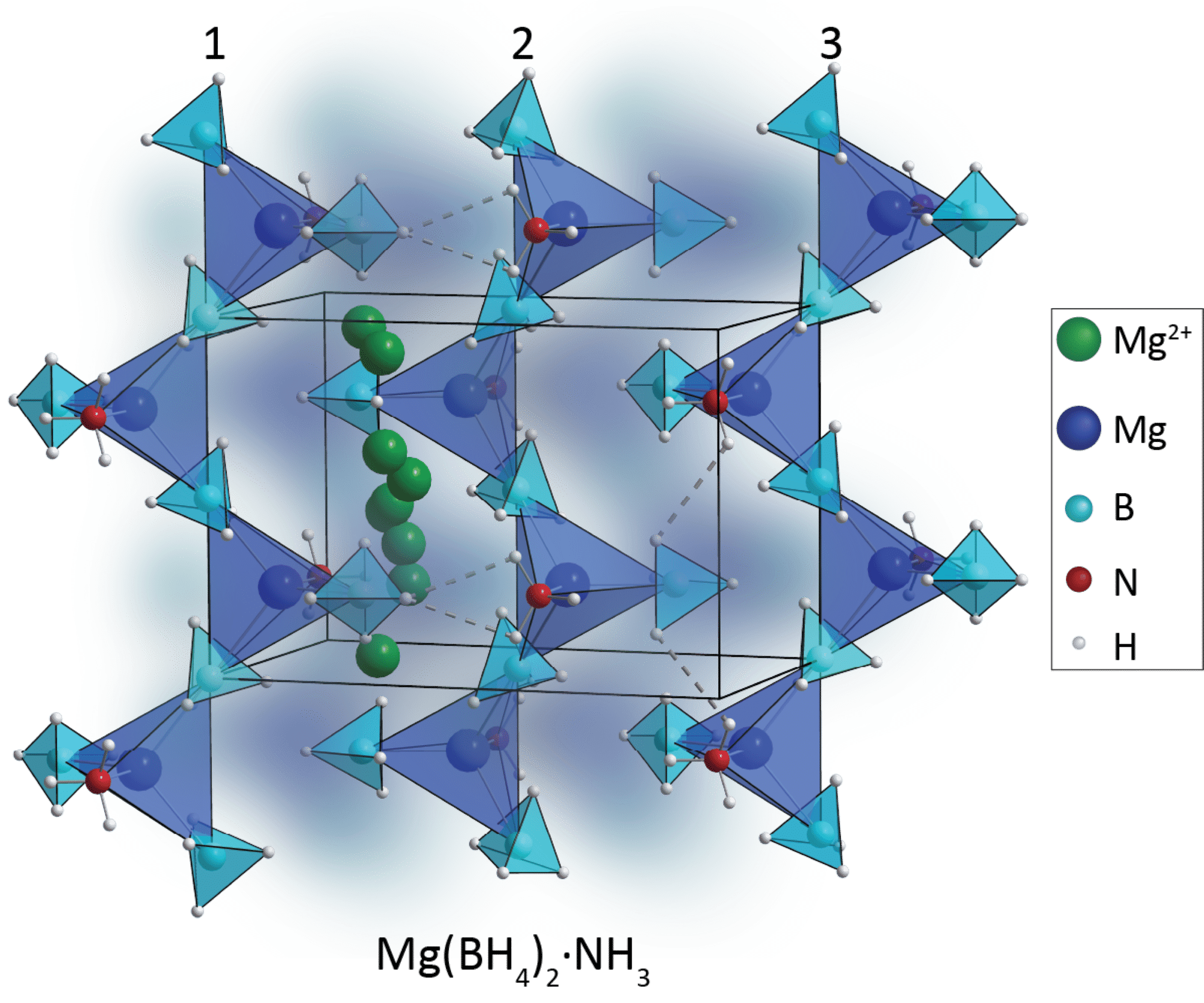
Det kan være svært at forestille sig, at de positivt ladede magnesiumioner kan bevæge sig igennem et fast stof som elektrolytten, der netop er en af udfordringerne i et faststofbatteri. Men det har Torben og hans forskningsgruppe en god løsning på. Ved at inkludere ammoniak i det nye materiale, tilføjer han polære molekyler, og der kan dannes svage såkaldte dihydrogenbindinger. Magnesiumionerne bliver i stand til at bevæge sig igennem materialet ved hjælp af ammoniakmolekylerne og dihydrogenbindingerne.
Hydrogenbindinger er svage tiltrækningskræfter mellem molekyler, hvor et hydrogenatom er bundet til et elektronegativt atom som oxygen, nitrogen eller fluor. Det svagt positivt ladede hydrogenatom kan tiltrækkes af et ledigt elektronpar på fx et oxygenatom i et andet nærliggende molekyle. Disse bindinger er vigtige for mange stoffers egenskaber, som fx vands høje kogepunkt og DNA’s struktur.
En dihydrogenbinding er en anden type hydrogenbinding, hvor der dannes en tiltrækning mellem to hydrogenatomer, som du kan se i figur 23. I dihydrogenbindinger sidder det ene hydrogenatom ofte i en kemisk forbindelse med et metalatom (kaldet hydrider). Hydrogenatomets elektronegativitetsværdi er højere end det metalatom, det er bundet til, og hydrogenatomet bliver derfor en lille smule negativt ladet (angivet med δ–). Det andet hydrogenatom er bundet til et elektronegativt atom som nitrogen i ammoniakmolekylet, og det bliver derfor en lille smule positivt ladet (angivet med δ+).

Dihydrogenbindingerne er svage tiltrækningskræfter og dannes og brydes let, og i Torbens elektrolyt hjælper de magnesiumionerne med at trænge igennem det faste stof. På den måde bevæger den sig igennem elektrolytten fra anoden til katoden under afladning af batteriet.
Torben arbejder med mange forskellige sammensætninger af nye borhydrider med magnesium eller calciumatomer. Formålet er at opnå en høj ionledningsevne ved lave temperaturer. En høj ionledningsevne betyder, at ioner bevæger sig hurtigt og effektivt gennem stoffet, hvilket gør det velegnet til at lede elektrisk strøm. Batterier skal jo helst kunne virke ved stuetemperatur og lavere. Han udtaler:
’De første faststofbatterier med magnesium er allerede udviklet og kan aflades og oplades igen. Så vi er allerede langt! De virker desværre kun ved relativt høje temperaturer omkring 60°C, og der har vi en udfordring. Nogle af de uorganiske materialer til elektrolytten, vi undersøger i min forskningsgruppe, ser ud til at fungere også ved stuetemperatur, så løsningen ligger ikke langt ude i fremtiden.’
Torben har altså en kemisk forklaring af, hvordan de positivt ladede metalioner som fx Mg2+ bevæger sig igennem det faste stof, og han har identificeret nye, uorganiske elektrolytmaterialer til elektrolytmateriale, der kan virke ved på stuetemperatur.
Se mere
Faststofbatterier rummer stort potentiale, og derfor er der mange forskere, der udvikler elektrolytter til disse. Forskerne på Danmarks Tekniske Universitet (DTU) har udviklet et nyt elektrolytmateriale baseret på kaliumsilikat, der er et almindeligt mineral udvundet af sten. Forskerne forventer, at det kan erstatte lithium i fremtidens elbilbatterier. Materialet er stabilt overfor luft og fugtighed, hvilket gør det muligt at producere det som papirtynde film, og det er en stor fordel ved batteriproduktion. Over de næste 10 år forventes denne teknologi at kunne levere et miljøvenligt, mere effektivt og mere sikkert alternativ til nuværende litiumionbatterier.
Det er naturligvis ikke kun i Danmark, man forsker i batterier. Hvis du er interesseret i at læse mere, om hvad der foregår indenfor batteriforskning ude i verden, kan du starte her.
6 Kan batterier løse energikrisen?
Nej, vi har brug for flere løsninger på samme tid! Batterier er vigtige til at lagre energi fra vedvarende kilder som sol og vind, men de kan ikke stå alene. Der er brug for en kombination af energikilder, effektiv energilagring, energibesparelser og udvikling af nye teknologier for at sikre en stabil og bæredygtig energiforsyning.
Her kommer kemikere ind i billedet. De arbejder med at finde nye, smarte materialer og reaktioner, så vi kan lave batterier, der holder længere, virker bedre og skader miljøet mindre. Måske bliver det en af jer, der er med til at udvikle de løsninger, vi har brug for. Kemi er nemlig ikke bare teori – det er også nøglen til fremtiden.