2.1.1 Faktaboks: Reaktionsskemaer
Sådan opskriver du et reaktionsskema
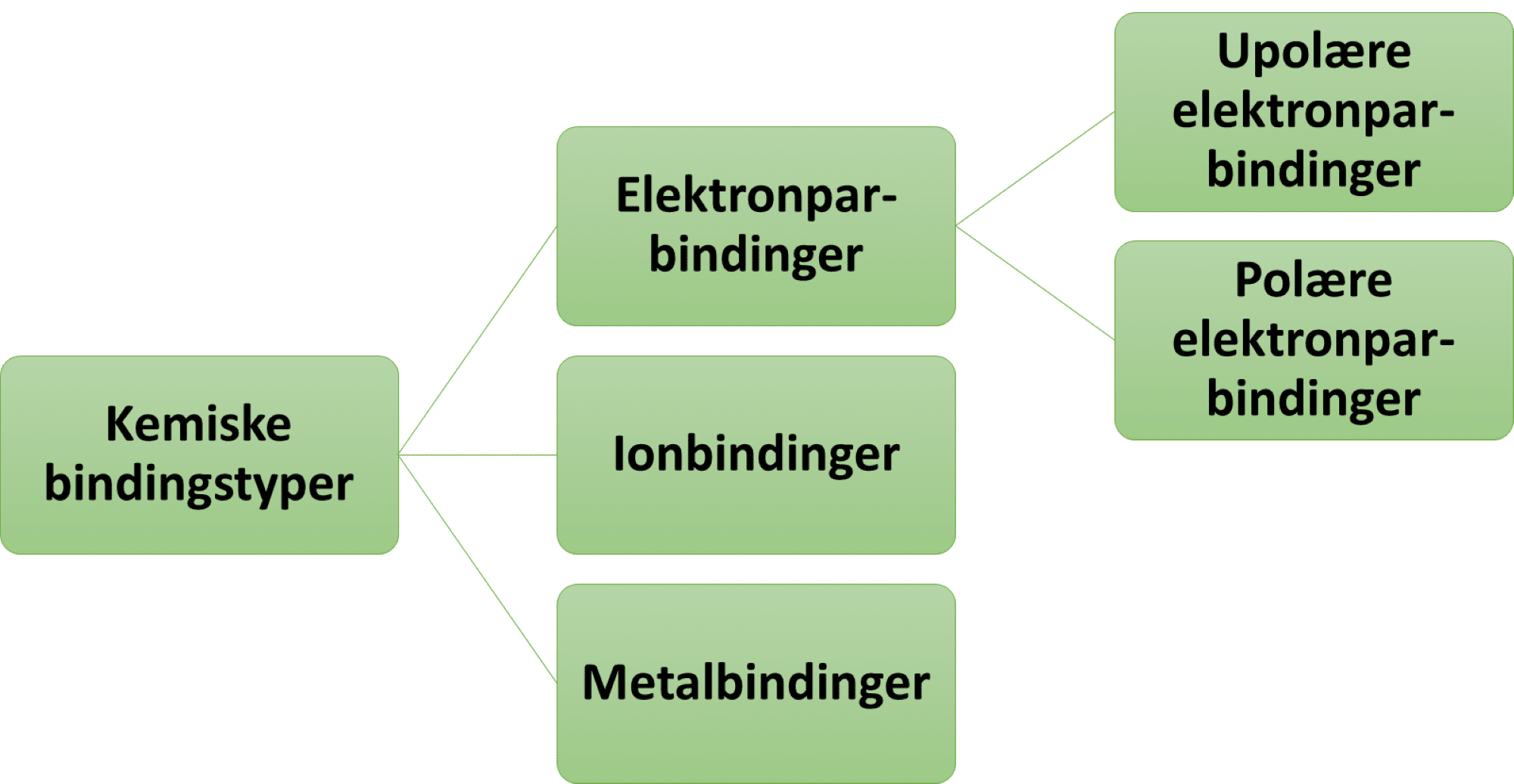
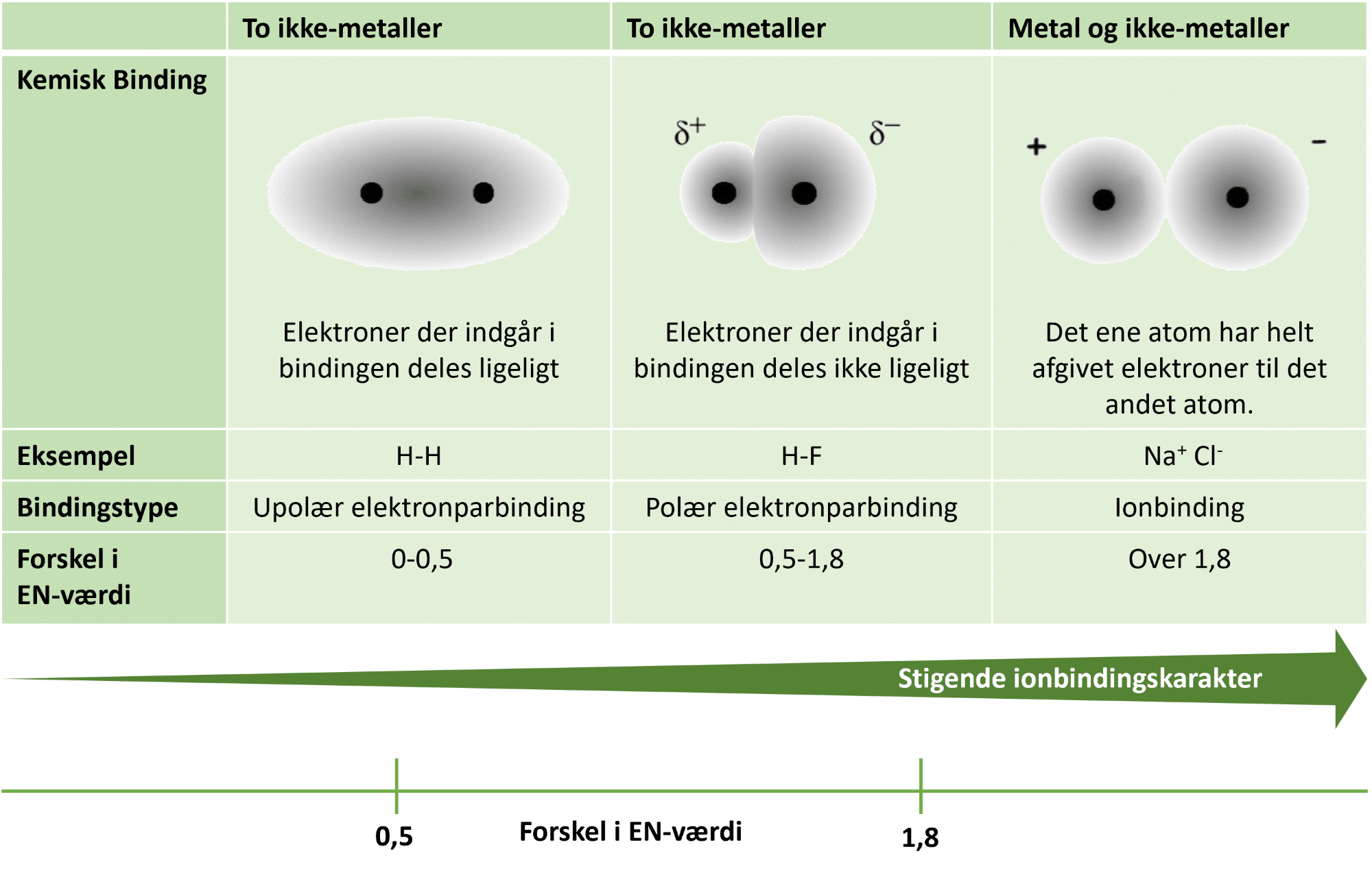
Når to eller flere atomer sidder sammen, er det vigtigt, at man kan aflæse hvilke grundstoffer, og hvor mange af hver slags atom, der sidder sammen. Det gøres ved at bruge grundstofsymbolerne og ved at sænke et tal bagved et atomsymbol, hvis det er større end et, for at angive antallet af atomer af dette grundstof. Du kender nok den kemiske formel for vand – H2O. Både atomsymbolet for hydrogen (H) og for oxygen (O) er med, så du ved, at stoffet består af hydrogen og oxygen. Det sænkede 2-tal angiver, at der er to atomer af grundstoffet lige inden 2-tallet, her hydrogen. Der er ikke sænket et tal bagved oxygensymbolet, da der kun er et oxygenatom. Et andet eksempel kan være kalk (calciumcarbonat), som der er meget af i undergrunden i Danmark. Det har den kemiske formel CaCO3. Der er tre forskellige grundstoffer: calcium (Ca), carbon (C) og oxygen (O). Der er et calciumatom, et carbonatom og 3 oxygenatomer.
Nu ved du, hvordan du skal skrive stoffer, som består af flere end et atom, så nu skal vi se på, hvordan man kan skrive reaktionsskemaerne helt korrekt. Som regel vil du vide noget om den reaktion, du skal opskrive i et reaktionsskema.
Udgangspunktet bliver den reaktion, som sker i grønne planter under fotosyntesen, hvor netop glukose dannes, som du har set molekylformlen for i opgave 4. I fotosyntesen bruger en plante carbondioxid (CO2), og vand (H2O). Dette er reaktanterne. I reaktionen omdannes de to reaktanter til to produkter, nemlig molekylet glukose (C6H12O6) og molekylet dioxygen, (O2).
Nedenfor opdeles opskrivningen af reaktionen i flere trin. Når du har øvet dig nogle gange, kan du efterhånden opskrive simple reaktioner i blot et trin.
1. Opskriv reaktionsskemaet med reaktanter, produkter, plustegn og reaktionspil:
CO2 + H2O → C6H12O6 + O2
Reaktionsskemaet er ikke færdigt endnu. Du har lært om tilstandsformer, og de skal skrives på i parentes bagved hver reaktant og hvert produkt. Derfor skal du vide lidt mere om stofferne. Måske ved du godt, at carbondioxid og dioxygen er på gasform. Vi indånder dioxygen, som kroppen bl.a. anvender i nedbrydningen af næringsstoffer, og derfra dannes carbondioxid (faktisk i præcis den modsatte reaktion, som vi er ved at opskrive!). I planten er glukosen opløst i vand, og vand er som bekendt flydende ved stuetemperatur.
2. Skriv tilstandsformerne i parentes bagved reaktanter og produkter:
CO2(g) + H2O(l) → C6H12O6(aq) + O2(g)
Der mangler stadig noget i dit reaktionsskema. Da der ikke kan opstå eller forsvinde atomer i en reaktion, gælder massebevarelsesloven, der lyder:
For hvert grundstof skal antallet af atomer være ens på begge sider af reaktionspilen.
Derfor skal du tælle antallet af atomer for hvert grundstof på begge sider af reaktionspilen. Dem kan du justere med et tal foran den kemiske formel for en reaktant eller et produkt. Dette tal kaldes for en koefficient. Dette trin kaldes at afstemme et reaktionsskema. I en bageopskrift, hvor der skal 3 æg og 400 g mel i dejen, er tallene 3 og 400 koefficienter, og de angiver antallet af det, der står bagved. Koefficienter er lettest at bruge, hvis de er hele tal (det giver heller ikke mening at bruge eller producere halve molekyler).
Før du læser videre, skal du prøve at tælle antallet af atomer på hver side af reaktionsskema vist i punkt 1, og se, om du når frem til dette:
Carbonatomer: 1 på venstre side og 6 på højre side
Hydrogenatomer: 2 på venstre side og 12 på højre side
Oxygenatomer: 3 på venstre side og 8 på højre side
3. Sæt koefficienter foran reaktanter og produkter således, at massebevarelsesloven er opfyldt.
6 CO2(g) + 6 H2O(l) → C6H12O6(aq) + 6 O2(g)
Nu stemmer antallet af carbonatomer, men ved at sætte koefficienten 6 foran carbondioxid, ændredes antallet af oxygenatomer på venstre side sig samtidig til 13 (6×2 + 1). Før vi kigger på antallet af carbonatomer, er det faktisk lettere at afstemme antallet af hydrogenatomer først.
6 CO2(g) + 6 H2O(l) → C6H12O6(aq) + 6 O2(g)
Nu er reaktionsskemaet afstemt. Lagde du mon mærke til, at man aldrig skriver koefficienten 1? Det gør man ikke, da det er underforstået og derfor unødvendigt.
For at lære, hvordan du læser et reaktionsskema højt, tager vi udgangspunkt i kageopskriften, som vi opstiller som et reaktionsskema. Opskriften lyder:
4 dl sukker, 3 dl mel, 4 spsk kakaopulver, 1 spsk bagepulver, 3 æg, 250g smeltet smør, 2 dl vand
Som reaktionsskema kan man skrive:
4 dl sukker + 3 dl mel + 2 spsk kakao + 1 spsk bagepulver + 3 æg + 250 g smør + 2 dl vand → kage
Hvis du skulle læse dette reaktionsskema højt, skal du faktisk sige det, der står i opskriften ovenfor: ‘4 deciliter sukker OG 3 deciliter hvedemel OG 2 spiseskeer kakao OG 1 spiseske bagepulver OG 3 æg OG 250 g smør OG 2 deciliter vand BLIVER TIL 1 kage’. Som du kan se, læses plustegn som ‘og’ og reaktionspilen som ‘bliver til’. Lad os prøve med det afstemte reaktionsskema ovenfor:
6 CO2(g) + 6 H2O(l) → C6H12O6(aq) + 6 O2(g)
Her skal du sige ‘6 carbondioxid på gasform og 6 vand på væskeform bliver til glukose opløst i vand og 6 dioxygen på gasform’.
Det kræver en del øvelse at læse reaktionsskemaer korrekt, og det er en del af det, der gør, at du er i stand til at tale ‘kemisprog’. For at hjælpe dig i dette materiale vil du kunne holde din mus hen over et reaktionsskema, hvorefter teksten, du skal sige, kommer frem. Du får også mulighed for at klikke på en lydfil, så du kan høre reaktionsskemaet læst højt.