1. Hvad er perspektiverne for power-to-X teknologien?
Se animationen, der er lavet af Rebecca Pittkowski. Hun er adjunkt på Københavns Universitet, og har tidligere været tilknyttet EU projektet ’Elcorel’ som du hørte om i animationen. Elcorel står for Electrochemical Conversion of Renewable Electricity into Fuels and Chemicals, som frit oversat betyder omdannelsen af fornybar elektrisk energi til brændstoffer og kemikalier. Rebecca forsker i Power-to-X.
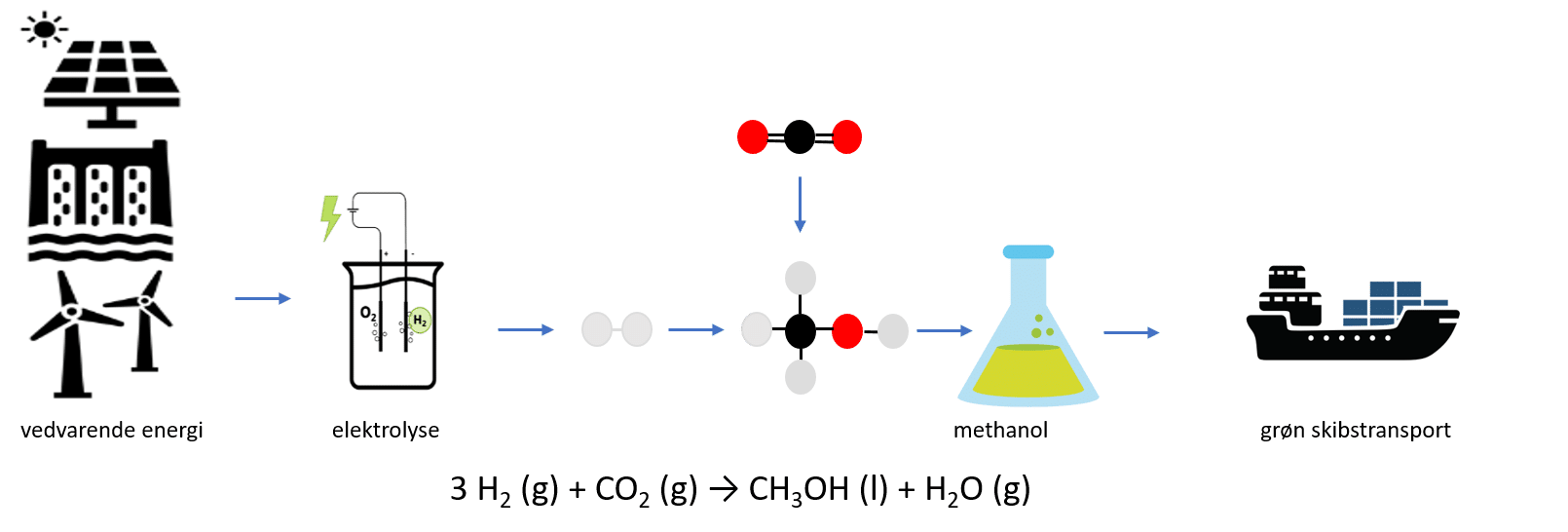
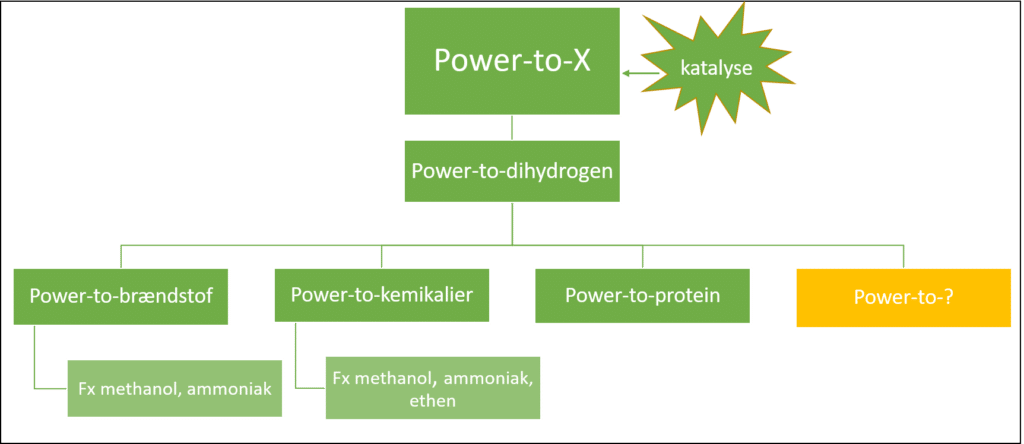
Power-to-X forkortet PtX er en teknologi, hvor elektricitet (power) fra vedvarende energikilder som fx vindmøller, solceller eller vandkraft, bruges til at drive en proces der hedder elektrolyse, der danner dihydrogen (H2, i daglig tale brint). Dihydrogen (X) kan enten bruges direkte som brændstof, eller omdannes videre til en række forskellige energirige stoffer (X). Det er er illustreret i figur 1.

Først, når der er overskud af vedvarende energi, kan det betale sig at danne X. For der er et energitab, når den elektriske energi omdannes til kemisk energi. Direkte elektrificering er mest energieffektiv, men ikke alt kan elektrificeres. Dér kommer PtX i spil, som vist i figur 2. Ud fra grøn energi kan man via PtX danne grøn dihydrogen. Den kan enten kan anvendes som brændstof eller kemikalie, eller kan omdannes videre til andre brændstoffer eller kemikalier, begge dele en slags indirekte elektrificering. Brændstoffer og kemikalier dannet via PtX teknologi omtales ofte som e-brændstoffer eller e-kemikalier, eller grønne brændstoffer og grønne kemikalier.
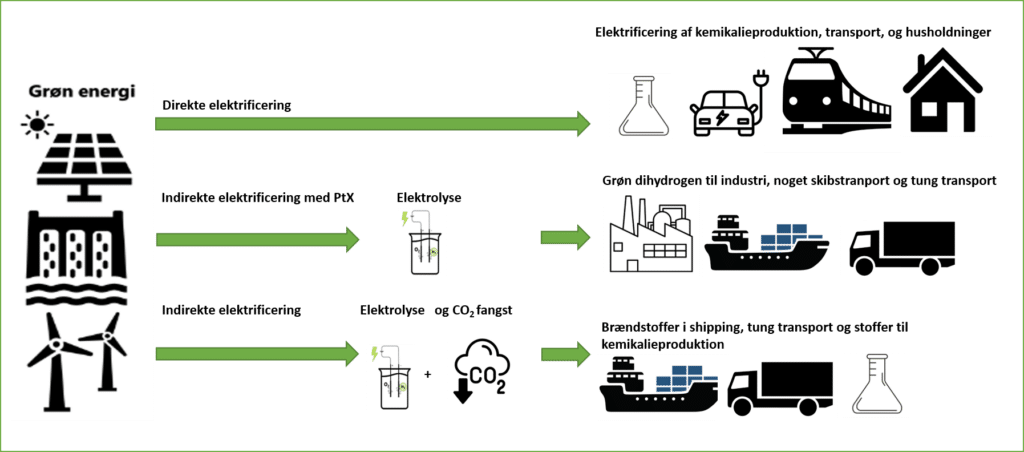
I den grønne omstilling står elektrificering altså først for, fx skal transportmidlerne i vid udstrækning elektrificeres. Men ikke alt kan elektrificeres. Derfor er der fortsat brug for at danne kemikalier og brændstoffer, på en mere bæredygtig og klimavenlig måde, som man kan via PtX. PtX teknologier har brug for at blive katalyseret, derfor hedder forløbet Power-to-X og katalyse. Nu er det tid til at se nærmere på, hvad der sker i PtX.
Se klippet før du læser videre.
Elektricitet fra vedvarende energikilder, kan altså bruges til at drive processen elektrolyse, hvor vand spaltes med brug af energi, og der dannes dihydrogen og dioxygen (O2, ilt) vist i reaktion 1)
2 H2O(l) → O2(g) + 2 H2 (g)
(1)
Elektrolysen er central i PtX, hvor elektrisk energi fra de vedvarende kilder omdannes til kemisk energi bundet i dihydrogen-molekylet. I perioder med overskydende ’grøn’ strøm fra vindmøller eller solceller er produktion af dihydrogen ved elektrolyse, en oplagt metode til at gemme energi på kemisk form til senere brug. I både batterier og brændstoffer (fx dihydrogen) er energien opbevaret på kemisk form, men batterier er tunge og ikke lige til at indsætte i flyveren eller containerskibet, ligesom der er et andet problem med batterier, nemlig tilgængeligheden af de råstoffer, der indgår i batterierne.
Ligesom i matematik er X en ubekendt. X’et i Power-to-X, er oftest dihydrogen, der i sig selv kan være et brændstof, eller udgangsstof i syntesen af andre stoffer som fx methanol (CH3OH), ammoniak (NH3), kemikalier eller endda proteiner, som illustreret i figur 3. Power-to-x reaktionerne du møder undervejs er katalyseret og katalyse præsenteres i sidste del.
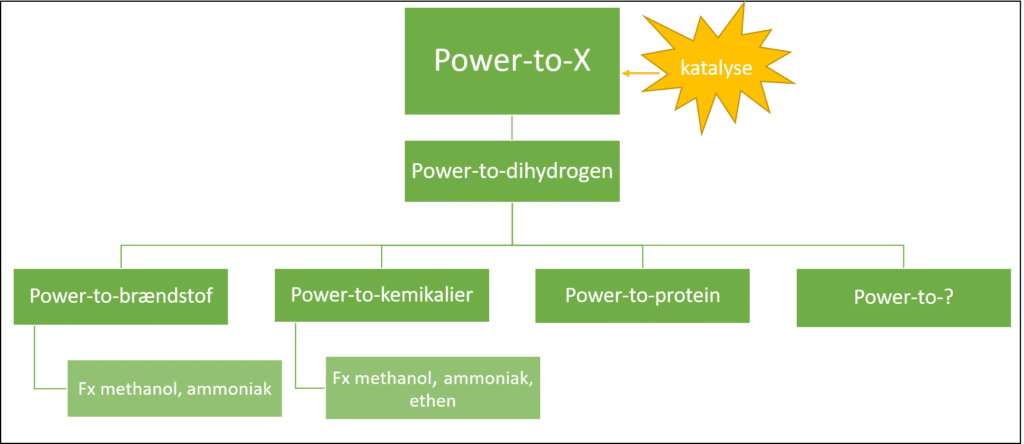
Først skal vi se på, hvad der sker kemisk i PtX.
Det er elektrolysen – spaltningen af vandmolekyler ved hjælp af vedvarende grøn strøm – der er centralt i PtX- teknologien. Derfor er det en forudsætning at produktionen af vedvarende energi øges både i Danmark og resten af verden.
I elektrolyseprocessen spaltes vand som vist i det overordnede reaktionsskema:
2 H2O(l) → O2(g) + 2 H2(g)
(1)
Det kræver energi, at bryde en kemisk binding, og den energi kommer fra en vedvarende energikilde. Produkterne er ud over dihydrogen, som er vores brændstof, noget så uskyldigt som dioxygen, der kan enten bruges i industrien eller sundhedsvæsnet, eller kan ledes direkte ud i atmosfæren.
Det samlede reaktionsskema for elektrolyseprocessen vist i 1) er en redox reaktion, altså en reaktion, hvor nogle stoffer oxideres, og derved afgiver elektroner, mens andre stoffer reduceres, hvorved de optager elektroner. Nedenfor ser vi nærmere på redoxreaktioner.
2. Redoxreaktioner
Redoxreaktioner er en reaktionstype du allerede kender, da alle forbrændinger er redoxreaktioner. Redoxreaktioner er centrale både i den organiske og i den uorganiske kemi, ligesom de er helt centrale i Power-to-X.
Redoxreaktioner er en samlet betegnelse for en reduktion og en oxidation. En reduktion er, når et stof optager elektroner, mens en oxidation er en afgivelse af elektroner. En huskeregel kan være ’ox-af’.
Vi ser på et eksempel.
Metallet kobber kan oxideres af luftens ilt (dioxygen), der herved reduceres:
2 Cu(s) + O2(g) → 2 CuO(s)
(2)
Redoxreaktionen viser, hvordan metallisk kobber oxideres til kobber(II)ioner, mens ilten reduceres til oxid (oxygen-ioner). Vi deler den overordnede redoxreaktion op i en reduktion og en oxidation:
Oxidation: 2 Cu → 2 Cu2+ + 4 e–
(3)
Reduktion: O2 + 4 e– → 2 O2-
(4)
Den samlede reaktion, altså reduktionen og oxidationen lagt sammen giver redoxreaktionen:
2 Cu + O2 + 4e– → 2 Cu2+ + 4 e– + 2 O2-
(5)
2 Cu(s) + O2(g) → 2 CuO(s)
(6)
I reaktion 6) ovenfor er dioxygen oxidationsmiddel, altså et middel der oxiderer andre stoffer, hvorved det selv reduceres. Dioxygen er et hyppigt forekommende oxidationsmiddel, men der findes en lang række andre oxidationsmidler, så langt fra alle oxidationer involverer oxygen.
Som du måske har lært tidligere, danner metaller altid positive ioner (indimellem omtalt som kat-ioner), hvorved de afgiver elektroner. Det kalder vi, at de oxideres. Derimod danner ikke-metaller oftest negative ioner (indimellem omtalt som an-ioner), fordi de optager elektroner, altså de reduceres. Det fremgår af eksemplet ovenfor.

Tidligere har du måske mødt begrebet elektronegativitet, ellers præsenteres elektronegativitet her [i]. Helt kort kan man sige, at elektronegativitet er et udtryk for et atoms evne til at tiltrække elektroner, som illustreret i figur 5.

Det er netop elektronegativiteten, der er med til at afgøre, hvorvidt et stof reduceres eller oxideres. Ved at opstille grundstofferne i en given kemisk redoxreaktion efter elektronegativitet, som i figur 6, kan vi få et overblik over, hvilke atomer der oxideres (dem med den laveste elektronegativitetsværdi), og hvilke der reduceres (dem med den højeste elektronegativitetsværdi) i en given kemisk redoxreaktion.
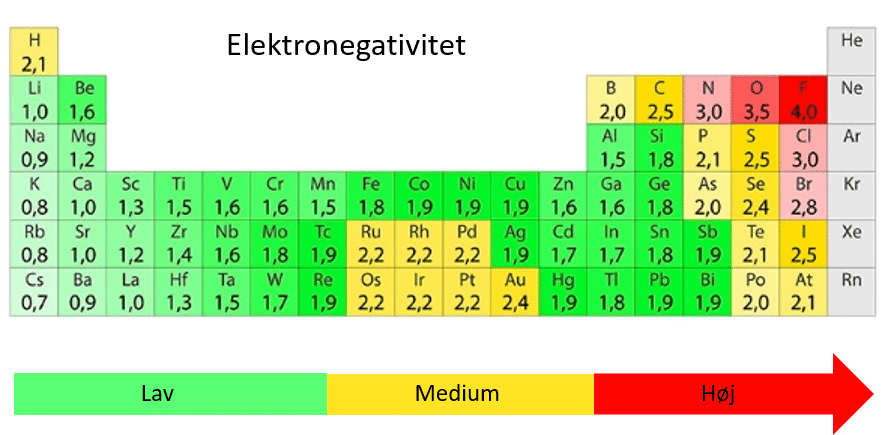
Kemikere har indført et smart lille værktøj til at holde regnskab med redoxreaktioner, nemlig oxidationstal.
Oxidationstal tildeles alle atomer i et molekyle eller et salt. Det er et redskab, man har indført, og tildeles alle atomer i et molekyle eller et salt, for at følge fordelingen af elektroner mellem atomerne, og hvordan disse ændres i en given reaktion.
Ved tildeling af oxidationstal får dét af de to atomer i bindingen (elektronparbinding eller ionbinding), der har den højeste elektronegativitet, alle bindingens elektroner. Når stoffet er et molekyle, der jo holdes sammen af elektronparbindinger, skal vi forestille os at elektronerne i elektronparbindingen helt overføres til det mest elektronegative grundstof. Princippet bag tildeling af oxidationstal, minder altså om tildelingen af ladninger, og svarer til en tænkt opsplitning af molekylerne i ioner.
Nedenstående regler gælder for tildeling af oxidationstal, en slags 5 trins raket.

De mest elektronegative grundstoffer får altså et negativt oxidationstal, mens de mindre elektronegative får et positivt oxidationstal. Fx har alle alkalimetallerne altid et oxidationstal på +I og jordalkalimetallerne har +II. Nogle grundstoffer, herunder nogle ikke-metaller og nogle overgangsmetaller kan have flere forskellige oxidationstal, alt efter hvilke andre atomer, der er i molekylet eller ionen.
Nedenstående regler gælder for tildeling af oxidationstal, en slags 5 trins raket.

De mest elektronegative grundstoffer får altså et negativt oxidationstal, mens de mindre elektronegative får et positivt oxidationstal. Fx har alle alkalimetallerne altid et oxidationstal på +I og jordalkalimetallerne har +II. Nogle grundstoffer, herunder nogle ikke-metaller og nogle overgangsmetaller kan have flere forskellige oxidationstal, alt efter hvilke andre atomer, der er i molekylet eller ionen.
Se mere
Overvej sammenhængen mellem et grundstofs oxidationstal og dets hovedgruppenummer. Vi vender tilbage til dette senere.
Se mere
Det er en tradition for, at oxidationstal (OT) tildeles med romertal, men det er intet krav. Lad os se på et par eksempler. Læg mærke til at man angiver det enkelte atoms oxidationstal. Bemærk også at summen af oxidationstal er lig med molekylets/atomets ladning (formelenhedens ladning).
Eksempel med tildeling af oxidationstal:
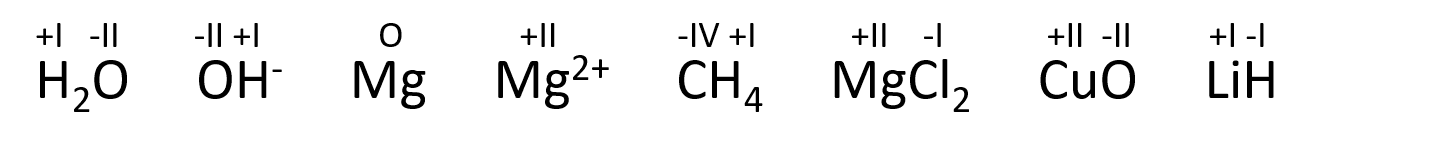
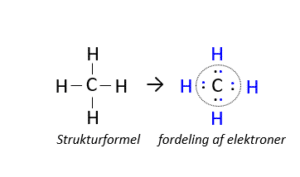
I vandmolekylet er hydrogen bundet sammen med et mere elektronegativt atom, hvorfor O tildeles begge elektroner fra hver af de to H, hvorved hvert H får OT= +I, og O’s OT= -II. Det samme gælder i hydroxid-ionen, her er de to atomers samlede ladning lig med ionen ladning. De frie grundstoffer har hverken optaget eller afgivet elektroner, så OT= 0. For simple ioner, er OT= ionenes ladning. For molekyler eller salte finder vi det mest elektronegative grundstof og fordeler elektronerne i yderste skal hertil. Når carbon i methan (CH4) tildeles alle 4 elektroner fra H, er C’s OT= -IV, mens hvert H afgiver en elektron og får OT= +I. Kun når H er det mest elektronegative grundstof i forbindelsen forekommer det i oxidationstallet –I, som i LiH, da H optager elektronen fra metallet.
Se mere
Tildel oxidationstal til følgende forbindelser, på samme måde som i eksemplet ovenfor.
| OT: | |||||||||
| Forbindelse | NaCl | NH3 | CaCl2 | Fe | Fe3+ | Cl2 | Cl– | HCl | CO2 |
Kendetegnende for redoxreaktioner er, at de indgående stoffer ændrer deres oxidationstal undervejs i reaktionen. Ved at tildele oxidationstal til de enkelte atomer på reaktant og produktsiden, og dokumentere denne ændring i oxidationstal, har vi belæg for, at en given reaktionen virkelig er en redoxreaktion.
Tilbage til sammenhængen mellem oxidationstal og hovedgruppenummer: For grundstofferne i hovedgrupperne gælder det som altid, at kun elektroner i yderste skal (valenselektroner), deltager i dannelsen af en kemisk binding. Det højest mulige oxidationstal er hovedgruppenummeret. Det svarer til, at alle elektronerne i yderskallen er afgivet, er hovedgruppenummeret. Det er dog langt fra alle grundstoffer i hovedgrupperne, der kan opnå så høje oxidationstal, der svarer til gruppenummeret. Omvendt er det laveste oxidationstal, altså hvor mange elektroner der maximalt kan optages, gruppenummeret – 8. Det skyldes jo, at elektronskallen så er fuld, hvorved ædelgasreglen (oktet- og dublet-reglen) er opfyldt.
Se mere

Hvis du har set demoforsøget, hvor metallisk natrium reagerer kraftigt med vand, kender du allerede reaktionen. Reaktionen er eksplosiv, når metallisk natrium kommes i vand. Reaktionen er en redox reaktion: 2 Na(s) + 2 H2O(l) → 2 Na+(aq) + 2 OH–(aq) + H2(g).
a. Hvilke atomer oxideres, og hvilke reduceres i reaktionen ovenfor?
b. Opskriv reduktionen og oxidationen som to særskilte reaktionsskemaer
c. Argumenter for at reaktionen er en redoxreaktion
Elektrolyse af vand (vist i reaktion 1), er en uorganisk redoxreaktion, mens andre power-to-X reaktioner, som eksempelvis power-to methanol, er en organiske redoxreaktioner, der netop er i fokus nedenfor.
Se mere
Det er faktisk ikke meget anderledes for organiske molekyler, når der skal tildeles oxidationstal, end beskrevet ovenfor.
Vi starter med at se på nogle et af de stoffer, vi støder på i PtX, nemlig methan, CH4.
Igen bruger vi en tabelværdi for elektronegativitet, som vist i figur 6, til at se at carbon er mere elektronegativt end hydrogen. Det betyder, at i elektronparbindingen mellem C og H, er elektronerne tættere på C end på H, som illustreret i figur 7. Carbon tildeles derfor alle bindingens elektroner. Carbon har optaget 4 elektroner i alt, dvs. Carbons OT= – IV, mens hydrogen har afgivet en elektron og derved OT= +I
Carbon kan have forskellige oxidationstal i forskellige forbindelser. I methan så vi carbon i dets laveste oxidationstal, mens du i carbondioxid, møder carbon i sit højeste oxidationstal. Figur 8 viser, hvordan hvert oxygen i CO2 tildeles de to elektroner fra carbon, der i alt afgiver sine fire elektroner. Det opskrives således:
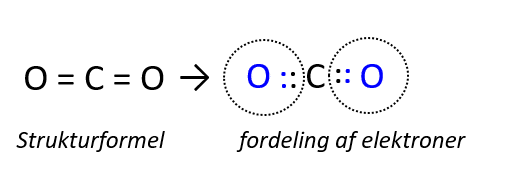
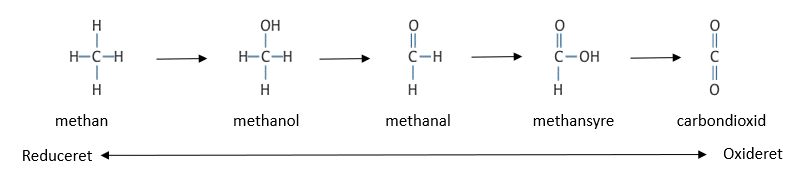
Figuren neden for viser simple carbonforbindelser med forskellige oxidationstal. Jo mere reduceret C-atomet er, jo mere energi indeholder molekylet. Du skal tildele oxidationstal til carbon i alle forbindelserne.
Se mere
så længe carbon ikke er på sit højeste oxidationstal indeholder molekylet fortsat energi og kan brænde, hvorved det oxideres. Alle forbrændingsreaktioner er nemlig redoxreaktioner.

Se mere
I et organisk molekyle med flere carbonatomer, kan hvert carbonatom have forskelligt oxidationstal. Man kan vælge at se på oxidationstal for hvert carbonatom, eller det gennemsnitlige oxidationstal for alle C-atomer, som vist i eksemplet nedenfor. Det er ligegyldigt for afstemning af redox-reaktioner om man ser på ’lokale’ eller ’globale’ oxidationstal for et givet grundstof. Til det formål er OT udelukkende et redskab til at sikre at antallet af elektroner er bevaret i den totale reaktion.
Eksempel: Vi ønsker at tildele oxidationstal til alkoholen ethanol, der indeholder to carbon-atomer:
Da de to carbon-atomer i ethanolmolekylet er bundet til forskellige grupper, der har forskellige elektronegativitetsværdier, så forventer vi, at oxidationstal for de to C-atomer er forskellige. Når oxidationstal skal tildeles til atomerne i ethanol, som vist på figuren, betragter vi, hver atomgruppe som et selvstændigt molekyle, symboliseret af en kasse på figuren.
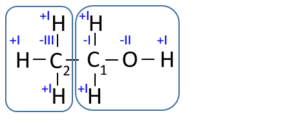
Elektronerne mellem C1 og C2 deles ligeligt, da elektronegativitetsværdien for C1 og C2 jo er ens.
C1: her er C bundet til en OH-gruppe og til to H-atomer, hvilket giver C1 et OT på -I, når summen skal give 0. Man kan også opstille det som et regnestykke, hvor C1 er X, den ubekendte: x+2∙1+(-2)+1 = 0 dvs. x= -1
C2: Her er C2 alene bundet til det mere elektropositive H, derfor bliver OT for C2 = -III. Et tilsvarende regnestykke kan opstilles for C2: x+3∙1 = 0, dvs. x = -3
Vi kan også se, at det gennemsnitlige oxidationstal for carbon i ethanolmolekylet er -II. Det er også hvad man kommer frem til ud fra ethanols sumformel:
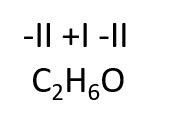
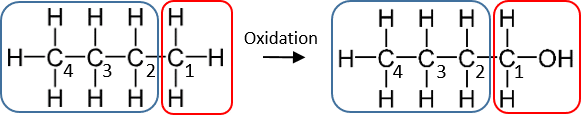
Ind imellem har man brug for at dokumentere, at en organisk forbindelse med mange carbonatomer, eller en bestemt gruppe i et stof, er blevet oxideret eller reduceret. Til at afgøre det, kigger vi kun på oxidationstallet for det atom, der ændrer oxidationstal. Alle andre atomer er uændrede. Hvis oxidationstallet for dette atom er steget, er der sket en oxidation, og hvis oxidationstallet er faldet, er der tale om en reduktion. Ser vi på figur 10, har C1 i butan et oxidationstal på -III, mens det tilsvarende C1 i butan-1-ol har oxidationstal på -I. Således er omdannelsen af alkanen butan til alkoholen butan-1-ol en oxidation. Der er tilsvarende sket en reduktion af et andet molekyle, som har optaget elektronerne, men det er ikke i fokus her. Alkoholen butan-1-ol kan altså dannes ved oxidation af butan.
Når man ser på større organiske molekyler, hvor der kun sker ændringer i en eller få grupper, er det oftest lettest at benytte ’lokale’ oxidationstal som vist i eksempel med ethanol. Når man sammenligner grupperne -CH2OH og -CHO, kan man indse, at oxidationen af eksempelvis ethanol (CH3CH2OH) til ethanal (CH3CHO ’tømmermændsmolekyle’) kræver at der fjernes to elektroner, dvs. C ændrer oxidationstal i gruppen fra –I til +I.
Nu skal du træne. Angiv oxidationstal (OT) til de C-atomer der ændrer oxidationstal og argumenter for, om omdannelsen er en oxidation eller en reduktion: Reaktionerne er ikke afstemte.

Se mere
Nu har vi den kemifaglige viden om redoxreaktioner på plads til at forklare, at Power-to-X reaktioner typisk indbefatter redoxreaktioner. Om lidt går vi i kødet på, hvad der sker i eksempelvis en power-to-methanol reaktion. Først skal vi dog omkring en helt central del af PtX, nemlig elektrolyse – vi starter med elektrolyse af vand.
3. Elektrolyse af vand – en redoxreaktion
Elektrolysereaktionen, hvor vand spaltes med brug af energi fra vedvarende energikilder, er ikke ny. I planternes fotosyntese spaltes vand med bruge af energi i form af sollys, hvorved der dannes dioxygen. Reaktionen kræver sollys og såkaldte co-enzymer, der er biologiske katalysatorer.

Vi kigger igen på elektrolysen af vand til brug i Power-to-X:
2 H2O(l) → O2(g) + 2 H2(g)
Se mere
2 H2O(l) → O2(g) + 2 H2 (g)
(1)
I elektrolysen af vand, vist i reaktion 1), er hvert hydrogenatom i vandmolekylet blevet reduceret, da hvert H-atom ændrer oxidationstal fra +I til 0. Da der i alt er fire H-atomer i alt i de to vandmolekyler, optages fire elektroner i de to dannede dihydrogenmolekyler på produktsiden. Tilsvarende er oxygen i vand blevet oxideret ved elektrolysen og har dermed afgivet elektroner. I alt afgiver de 2 oxygenatomer i vand 4 elektroner. I elektrolysen, hvor to vandmolekyler spaltes, flyttes altså i alt fire elektroner fra oxygen til hydrogen.
Samspillet mellem elektricitet og kemi kaldes for elektrokemi, og også her er redoxkemi central. Mens der i et batteri i brug sker en omdannelse af kemisk energi til elektrisk energi, sker omdannelsen af elektrisk energi til kemisk energi via processen elektrolyse, som illustreret i figur 11.
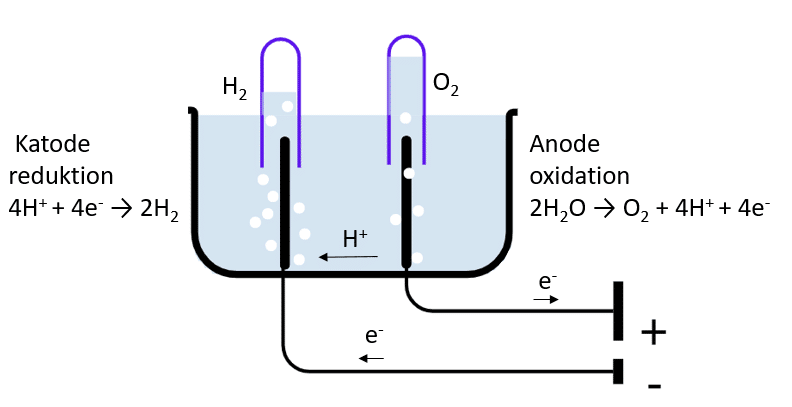
Ved elektrolysen sendes strøm gennem en opløsning, her vand, som vist i figur 11. Energiforskellen mellem reaktanter og produkter (her vand og dioxygen samt dihydrogen) er den mindste energimængde, der er nødvendig for at reaktionen kan forløbe. Hvor meget ekstra energi, der egentlig skal til for at drive elektrolyseprocessen, angives normalt som noget, der hedder ’overpotentiale’. Overpotentialet skal helst være så lille som muligt.
Under elektrolysen vil ionerne i opløsningen vandre mod de elektriske poler, så de positive ioner vandrer mod den negative pol. Mellem disse to poler (elektroder) er den væske, der skal udsættes for elektrolyse. Kun meget lidt af vandet er ioniseret, så for at elektrolysen af vand skal gå hurtigere tilsættes ioner (dvs. elektrolytter), der således katalyserer reaktionen og ikke selv forbruges, da de gendannes. I forsøget her tilsættes elektrolytter i form af fortyndet svovlsyre (0,1 M H2SO4 (aq)).
Ved anoden sker en oxidation, og der sker reduktion ved katoden (huskeregel: konsonanter (reduktion katode) passer sammen og vokaler (oxidation anode) passer sammen), som vist på figur 11. Hydroner (H+, hydrogen-ioner)) fra vand (vands selvionisering) og fra svovlsyren søger mod den negative pol (katoden), hvorved hydronerne reduceres, mens elektroner løber gennem det ydre kredsløb modsatte vej, nemlig mod anoden. I elektrolyse er anoden altså den positive pol, da det er ved anoden, at oxidationen sker.
Elektrolysen af vand sker eksperimentelt i et elektrolysekar, hvor man har rent demineraliseret vand tilsat elektrolyt. Man kan dog også lave forsøget uden elektrolysekar, men blot med et bægerglas og elektroder.
Både øvelsesvejledning med elektrolysekar, og øvelsesvejledning uden elektrolysekar findes under ’Eksperimenter’.
Nogle få simple kemikalier dannes ved hjælp af elektrolyse, hvor principperne er de samme, som i det forsøg, du netop selv har udført. Dvs. der kræves elektricitet til at drive processen, og processen er dermed et eksempel på direkte elektrificering, som nævnt i tidligere.
Dichlor (Cl2, chlorgas), bruges bl.a. i dannelsen af plastiktypen PVC og er på listen over de vigtigste industrielle kemikalier i verden. Produktionen af dichlor er baseret på elektrolyse, en særlig slags elektrolyse, der omtales som ’chlor-alkali-elektrolyse’. Her er en mættet opløsning af natriumchlorid, (almindeligt køkkensalt) udgangsstoffet. Den overordnede reaktion i elektrolysen af saltvandet kan opskrives:
2 NaCl(aq) + 2 H2O(l) → Cl2(g) + H2(g) + 2 NaOH(aq)
(7)
Dannelsen af dichlor er faktisk en af de få processer, der ikke behøver tilstedeværelse af en katalysator. Processen er stadig meget energikrævende, og energien hertil kommer typisk fra fossile brændsler (som naturgas). Hvis man på sigt løser energiudfordringen, ved at skaffe mere vedvarende energi, kan også produktionen af dichlor blive mere grøn, og ’Power-to-chlor’ vil i så fald være et eksempel på en anden power-to-X produktion. Processen er i forvejen uden spildprodukter, da biproduktet natriumhydroxid også er et meget anvendt kemikalie.
a) Benyt reaktionsskema 7 ovenfor, til at argumentere for, at produktionen af dichor via elektrolyse er en redoxreaktion.
b) Kom med bud på, hvorfor processen omtales som chlor-alkali-elektrolyse.
c) Beskriv ligheder og forskelle mellem elektrolyse af vand og elektrolysen af saltvand (chlor-alkali-elektrolyse).
Se mere
at man ligeledes kan danne hydrogenperoxid (H2O2, brintoverilte) et af de vigtigste kemikalier i verden, direkte via elektrolyse? Det kan i fortyndet form også benyttes i afblegning af tøj og hår, men hovedbrugen er nu blegning i papirindustrien.

Et dansk firma HPNow har til huse i Søborg uden for København. Her har kemi, iværksætteri og interesse for bæredygtighed, banet vejen for en ny kemivirksomhed, der producerer grøn hydrogenperoxid.

Hydrogenperoxid er et vigtigt kemikalie i industrien til produktion af bl.a. papir, kemikalier og behandling af spildevand. Det har også stor anvendelse på hospitaler, hvor det anvendes som et desinfektionsmiddel, der ikke er skadeligt for miljøet. Måske kender du hydrogenperoxids trivialnavn brintoverilte fra hverdagen som desinfektionsmiddel, eller blegemiddel af fx tøj og hår.
Det meste af verdens hydrogenperoxidproduktion i dag (95%), baserer sig på fossile brændstoffer og produceres via en meget energikrævende proces. Dertil kommer at produktet, hydrogenperoxid, der er både reaktivt og eksplosivt, efterfølgende skal transporteres rundt i verden.
Det vil – og kan – den danske kemivirksomhed HPNow gøre op med. HPNow producerer nemlig ’grøn’ hydrogenperoxid med Power-to-X teknologi, og det sker ’on demand’ og ’on site’.
Kernen i virksomheden er et power-to-X anlæg på størrelse med et køleskab, som iværksætterne selv har udviklet, patenteret og lanceret. Det er vist i figuren nedenfor.

Power-to-X anlægget, danner hydrogenperoxid H2O2 ud fra elektrolyse af vand. Energien til elektrolysen kommer fra vedvarende energikilder. Processen kan lidt forsimplet illustreres sådan:
Ved anoden oxideres vand, ligesom i elevforsøget med elektrolyse af vand:
Anoden (+): 2 H2O(l) → 4 H+(aq) + 4 e– + O2(g)
Membranen vist mellem de blå elektroder på figur 12, er gennemtrængelig for hydroner (H+). Ved katoden reduceres dioxygen fra luften og i sur opløsning dannes hydrogenperoxid:
Katode (-): O2(g) + 2 e– + 2 H+(aq) → H2O2(aq)
Når reaktioner ved anode og katode lægges sammen, kan en samlet reaktion for dannelsen af hydrogenperoxid opskrives:
2 H2O(l) + O2(g) → 2 H2O2(aq)
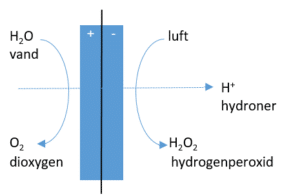
Den dioxygen, der anvendes, kommer fra atmosfæren som vist på figuren, hvorefter det opkoncentreres og indgår i reaktionen som en reaktant.
Processen er dog ikke helt så simpel, og kræver …. du ved det måske allerede?… Katalysatorer!
Den grønne hydrogenperoxidproduktion kan således ske ’on site’, dvs. helt lokalt, og igangsættes når der er behov, dvs. ’on demand’. Ift. den konventionelle måde at producere hydrogenperoxid på, omtalt indledningsvist, kan HPNows teknologi sparre atmosfæren for op mod tre tons CO2, pr. ton hydrogenperoxid, forudsat at energien, der indgår i produktionen, er grøn.

Se mere

a) Undersøg selv, hvad den producerede hydrogenperoxid omtalt i faktaboksen, anvendes til?
b) Hvorfor er denne måde at producere hydrogenperoxid på ’grøn’?
c) Tjek, at de to reaktionsskemaer tilsammen giver reaktionsskema for den samlede produktion af hydrogenperoxid.
d) Forklar, hvorfor processen er en oxidation, idet du inddrager oxidationstal for reaktanter og produkter. Strukturen af hydrogenperoxid er vist her: HO-OH
e) Diskuter forskelle og ligheder ift. jeres elevforsøg med elektrolyse af vand.
f) Som nævnt ovenfor produceres hydrogenperoxid ’ on-site’ og ’on-demand’. Hvad ligger der i disse begreber, og hvorfor er det smart? Er der nogle ulemper forbundet hermed?
Se mere
4. Hvad er X?
Nu har du selv prøvet at lave dihydrogen ved elektrolyse af vand, en helt central del i PtX. Dihydrogen, er et brændstoffer med høj energitæthed målt som energimængde pr. masse, og kan derfor også fungere som energilager, når der er overskud af vedvarende energi, men det fylder meget, da det er på gasform og det er en udfordring. For sammenligning med andre brændstoffer, som naturgas, benzin og methanol se figur 13.
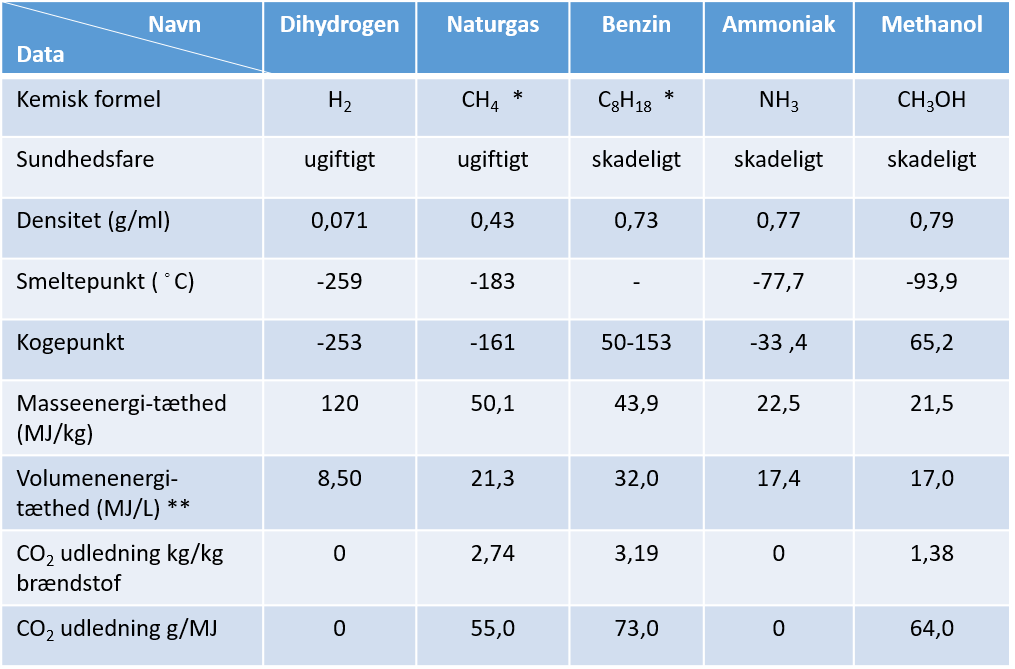

Kig godt på figur 13. Nedenfor skal du analysere og forklare dele af figuren.
a) Hvilken tilstandsform har hver af de fem energikilder ved stuetemperatur?
b) Hvilke af energikilderne indeholder mest energi målt i masseenergitæthed.
c) Hvilke af energikilderne indeholder mest energi målt i volumenenergienergitæthed.
d) Hvilke energikilder udleder ved forbrænding ikke noget CO2? Hvorfor?
Se mere
Dihydrogen dannet fra industrielle elektrolyseanlæg, når der er masser af vedvarende energi, kan altså i nogle tilfælde benyttes som klimavenligt brændstof, da det ved forbrændingen ikke udleder CO2. Produktet er noget så uskyldigt vand. Det omtales som 0-udledning (0-emission) af kuldioxid.
Især busser og lastbiler, der kører på dihydrogen, er der fokus på, og de findes på vejene allerede. Her er der overordnet to strategier: enten har køretøjet en såkaldt brændselscelle. Den kan anvende dihydrogen til at generere elektricitet til den elektriske motor. Den anden mulighed er, at dihydrogen benyttes som brændstof i en forbrændingsmotor. Men dihydrogen er eksplosivt og gassen fylder meget. Derfor diskuteres det stadig, om dihydrogen i praksis kan fungere som brændstof i transportsektoren.

a) Dokumentér med et afstemt reaktionsskema hvad der sker ved en forbrænding af dihydrogen.
b) Når brint-biler og el-biler omtales som 0-emission af kuldioxid, altså at der ikke udledes carbondioxid i forbrændingen, er det rigtig nok. Men alligevel er hverken brintbiler eller elbiler CO2 Hvorfor egentlig ikke?
c) Opgaven indbefatter kemisk mængdeberegning. Ud fra det afstemte reaktionsskema i a), skal du beregne, hvor meget vand, der dannes fra en bus, der kører på dihydrogen. Bussen rummer 37,5 kg dihydrogen, hvilket giver en rækkevidde på over 400 kilometer.
Se mere
Dihydrogen, dannet ved elektrolyse kan også bruges til produktionen af ammoniak, der kan anvendes til gødning, men også som brændstof, hvilket er ret nyt.
5. Hvad er power-to-ammoniak?
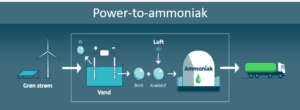
I dag bruges omkring 1% af verdens samlede energiforbrug på at danne ammoniak. Processen med at danne ammoniak står for omkring 1-2% af verdens CO2 udledning. Ammoniak er en helt centralt bestanddel i kunstgødning og uden gødning, lavere høstudbytte, og det går ikke med en stigende befolkning på verdensplan. Før vi ser på, hvordan man i fremtiden kan danne ammoniak på en mere bæredygtig måde, skal vi se på, hvordan syntesen af ammoniak foretages i dag.
Processen, hvor ammoniak dannes, hedder Haber-Bosch processen, og er vist i reaktion 8).
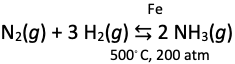
(8)
Den foregår ved, at dinitrogen fra luften, reagerer med dihydrogen og danner ammoniak. Ammoniak er et af de stoffer, der produceres mest af på verdensplan, og stoffet er vigtigt for fødevareproduktionen i hele verden.
45-50% af jordens befolkning brødfødes alene baseret på én enkelt kemisk reaktion – Haber-Bosch processen, der producerer gødningen ammoniak? Uden den, ville der kun kunne brødfødes halvt så mange mennesker på kloden. Vi er dybt afhængige af, at denne reaktion forløber så effektivt som muligt, for at producere nok føde.
I Haber-Bosch reaktionen vist i reaktion 8, skal flyttes ’vanvittigt’ mange elektroner, derfor er reaktionen svær at få til at løbe. I opgaven her skal du bl.a. undersøge hvor mange elektroner, det drejer sig om.
a) Tildel oxidationstal til alle atomer, der indgår i reaktion 8.
b) Hvilke atomer oxideres og hvilke reduceres?
c) Hvor mange elektroner flyttes i alt i reaktion 8?
d) Hvad gør man for at facilitere og øge reaktionshastigheden af denne reaktion?
Se mere
Derfor er forståelsen af reaktionen i 8) og optimeringen heraf stor. Reaktionen (8) ser simpel ud, men den forløber bestemt ikke lige af sig selv. Det kræver en større mængde energi at splitte det superstabile dinitrogenmolekyle ad, der jo er holdt sammen af tripelbindingen. Men også elektronparbindingen mellem de to hydrogenatomer i dihydrogenmolekylet er stærk, det kræver meget høje temperaturer at spalte molekylet til hydrogenatomer.
Så processen i 8), kræver dels tilstedeværelse af katalysatorer (her en jernkatalysator), dels at reaktionen forløber ved højt tryk og høj temperatur, disse reaktionsbetingelser af angivet i reaktionsskemaet. Dinitrogen stammer fra atmosfæren, mens dihydrogen i den ’normale Haber-Bosch proces’ stammer fra fossile brændsler bl.a. naturgas (hovedbestanddelen i naturgas er methan, CH4) og ikke fra fx elektrolyse af vand. Derfor er fossile brændstoffer involveret i dannelsen af hele verdens ammoniakproduktion, som det er i dag.
bælgplanter som ærter og kløver, binder luftens dinitrogen i rodknolde vha. bakterier, der har et meget kompliceret enzym, og omsætter det til ammoniak? På den måde mestrer planternes enzymer at katalysere en yderst vigtig proces, noget vi kan lære af.
a) Argumenter for at reaktionen vist i 8) er en redox reaktion.
b) Ved den normale Haber Bosch proces stammer dihydrogenen fra naturgas. Vi ser nærmere på den reaktion her: Opskriv et reaktionsskema, for hvordan methan, CH4, der er hovedbestanddelen i naturgas, kan danne 3 molekyler dihydrogen, når methanen bringes til at reagere med vanddamp i en forbrændingsmotor. Hvilket biprodukt opstår ved reaktionen? Hvad hedder molekylet?
Se mere
Men hvad hvis nu dihydrogen i ammoniakproduktionen i stedet for kommer fra elektrolyse af vand?
Power-to-ammoniak er nu realitet i Danmark, hvor danske virksomheder har anlæg til såkaldt e-ammoniak. E-ammoniak er dannet ud fra dihydrogen, produceret via elektrolyse og ud fra luftens dinitrogen. Energien hertil, kommer fra vedvarende energikilder, som vist på figur 14. E-ammoniak omtales også som grøn ammoniak. Perspektiverne er, at anlægget skal producere op til 5.000 ton grønt ammoniak årligt.
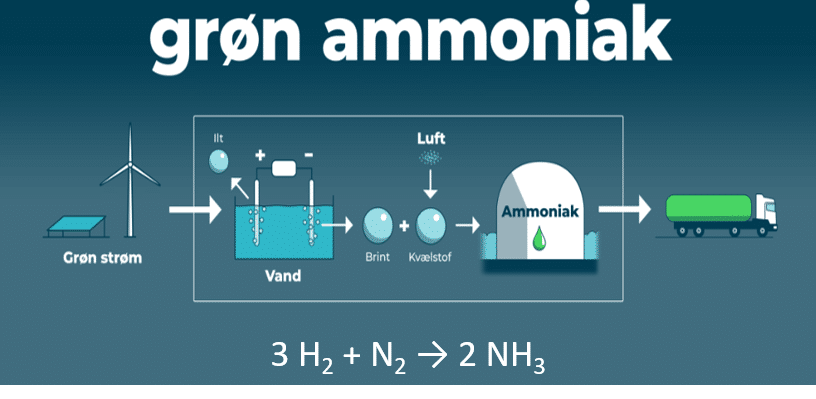
Se denne korte explainer.
Ammoniakproduktion, som vist i 8), kræver fortsat store mængder af energi og kræver som nævnt en katalysator. Reaktionsmekanismen, altså den måde reaktionen sker på, er meget kompliceret, og fremstillingen af ammoniak sker igennem flere reaktionstrin på katalysatoren. Nogle gange undervejs i PtX, støder du på katalysatorer. Der arbejdes med forskellige typer af katalysatorer, alt efter hvilken slags proces, der skal laves. Vi vender tilbage til katalysatorer i et senere afsnit, og her ser du også, hvordan jernkatalysatoren øger reaktionshastigheden af Haber-Bosch reaktionen.
fødevarer som ris, og tøj produceret i f.eks. Asien, oftest transporteres til Danmark via transport med containerskibe? Hvis vi mindsker vores forbrug af tøj og gadgets fra bl.a. Asien, mindsker vi også klimaaftrykket.
Der er allerede containerskibe, der benytter ammoniak som brændstof. Noget tyder på, at olie til skibstransport måske helt forbydes, men dette er en politisk beslutning. Ammoniak har potentiale som et kulstoffrit alternativ til konventionelt brændstof. E-ammoniak, har fordelen, at det på papiret kan opnå en nuludledning af CO2, som det fremgår af dette reaktionsskema:
4 NH3(g) + 3 O2(g) → 2 N2(g) + 6 H2O(g)
(9)
Ammoniak indeholder ikke noget kulstof og udleder derfor ikke CO2, når det forbrændes. Ulempen er dog, at forbrændingen i praksis kan danne NOx (dvs. forskellige nitrogenoxider, nitrøse gasser), alt efter hvordan forbrændingen forløber. Dette er ikke illustreret i reaktionsskemaet i 9). PtX baseret grøn ammoniakproduktion har således gode muligheder for at spille en væsentlig rolle i den grønne omstilling.
Ammoniak kan indeholde meget kemisk energi, pga. den relativt høje energitæthed, som vist i figur 13. På den måde kan det måske bruges som energilager til opbevaring af overskudsenergi, når der er vedvarende energi i overflod, og det kan anvendes som brændstof. Men ammoniak kan også indgå i syntesen af sprængstof, og i dannelsen af den giftige forbindelse hydrogencyanid (HCN) og ammoniak er i sig selv en giftig og ætsende gas, så der er nogle ulemper forbundet hermed. Endelig skal størstedelen af ammoniakproduktionen fortsat gå til gødning, da hele verdens befolkning skal kunne brødfødes.
Reaktionsskema for forbrænding af ammoniak er vist i reaktion 9. Vi kigger igen på reaktionsskemaet:
9) 4 NH3(g) + 3 O2(g) → 2 N2(g) + 6 H2O(g)
Vi dykker lidt ned i kemien i ammoniakforbrændingen:
a) Tildel oxidationstal til alle atomer, der indgår i reaktion 9.
b) Hvilke atomer oxideres og hvilke reduceres?
c) Hvor mange elektroner flyttes i alt i reaktion 9?
d) Hvilke oxidationstal for nitrogen møder du i reaktion 9?
e) Nitrogen står i hovedgruppe 5. Sammenhold hovedgruppenummer, med nitrogens højest mulige oxidationstal, og lavest mulige oxidationstal er. Der er hjælp at hente her (indsæt link til s. 9, hvor der står ’Det højest mulige oxidationstal er hovedgruppenummeret. ..)
f) Hvad kan man gøre for at øge reaktionshastigheden af reaktion 9?
Se mere
Der er dog stadig brug for carbonbaserede stoffer, som næste afsnit illustrerer, for vi har fortsat brug for materialer, kemikalier og andre brændstoffer.
6. Hvad er power-to-methanol?
Methanol kan benyttes som brændstof, da det er et energitæt molekyle, som det fremgår af figur 13. Hvis man opskriver formlen for carbonhydridet methan, CH4, og derefter udskifter et H med en OH-gruppe (en hydroxy-gruppe), får man formlen for methanol CH3OH. Methanol tilhører stofklassen alkoholer, og methanol er den simpleste alkohol. Hydroxyforbindelser er en samlet betegnelse for stofklassen alkoholer og for stofklassen phenoler (aromatiske hydroxyforbindelser). Du kender alkoholen ethanol, CH3CH2OH som vi nogenlunde kan tåle at drikke i begrænsede mængder. Det gælder ikke for methanol, hvis trivialnavn er træsprit. Man kan blive blind af at drikke methanol, da det i kroppen oxideres til methanal (CH3CHO), der reagerer med proteiner i blandt andet øjet. Man kan faktisk dø af at indtage det i større mængder.
Begge alkoholer har suffixet -ol, og har en række andre anvendelser end alkoholiske drikke. Begge alkoholer kan anvendes som brændstof og især methanol også som et kemikalie, der indgår som en slags ’byggeklods’ i produktionen af en del andre stoffer.
I dag dannes methanol primært fra naturgas, dvs. et fossilt brændsel.
Nu kan man lave methanol ud af dihydrogen dannet fra PtX. Carbondioxiden kommer fra atmosfæren eller såkaldte punktkilder (kilder med stor CO2 udledning fx forbrændingsanlæg), eller kan stamme fra biogasanlæg (anlæg der omsætter madaffald og affald fra landbrug og industri til energi). Reaktanterne dihydrogen og carbondioxid bringes til at reagere under de rigtige tryk, temperaturer og under brug af den rigtige katalysator. Reaktionsskemaet er vist nedenfor:
3 H2(g) + CO2(g) → CH3OH(l) + H2O(g)
(10)
Den samlede reaktion dækker over to delreaktioner:
H2(g) + CO2(g) → CO(g) + H2O(g)
(11)
CO(g) + 2 H2(g) → CH3OH(l)
(12)
a) Tjek at de to delreaktioner i 11 og 12 ovenfor, tilsammen giver den samlede reaktion 10.
b) Tildel oxidationstal til alle atomer, der indgår i reaktion 10.
c) Hvilke atomer oxideres og hvilke reduceres?
d) Hvor mange elektroner flyttes i alt i reaktion 10?
Se mere
Methanol, der dannes fra PtX, omtales e-methanol. Ofte angives processen som power-to-methanol, den er illustreret i figur 15. Methanol kan også dannes fra biologiske processer fx en fermentering (gæring), denne omtales bio-methanol (ligesom du måske har hørt om bio-ethanol). E-methanol kan altså være et flydende brændstof til skibstrafikken, eller danne basis for produktionen af en andre kemikalier eller brændstoffer. Kemisk er der dog ikke forskel på methanol, e-methanol og bio-methanol – det er måden, det er lavet på, der er forskellig.
a) Forklar for hinanden, hvordan methanol kan dannes via Power-to-methanol. Brug figur 15.
b) Redegør for, at omdannelsen af carbondioxid til methanol (power-to-methanol), er en reaktion af typen redoxreaktion.
c) Reaktion 10 skal katalyseres. Kan man ud fra reaktionen se det? Hvordan kunne man evt. have illustreret dette?
d) Vurder, ved at bruge data i figur 13, hvorfor væsken methanol, er at foretrække som brændstof i forhold til gassen H2?
Se mere
De første containerskibe, der benytter methanol som brændstof, er klar til brug. Containerskibe til transport (shipping) står for op mod 3 % af verdens CO2-udledning globalt, så PtX baseret grøn methanolproduktion har også gode muligheder, for at spille en væsentlig rolle i den grønne omstilling.
a) Opskriv et afstemt reaktionsskema for forbrændingen af alm. skibsbrændstof (olie) og et for forbrændingen e-methanol. Antag at reaktionen er en fuldstændig forbrænding. Det er desværre langt fra tilfældet med forbrænding af olie, men en bedre antagelse, når det gælder forbrænding af methanol. Sammensætningen af olie til skibstransport (Heavy Fuel oil, på dansk: bunkerolie) varierer, men du kan bruge formlen C8H18.
b) Skibsbrændstof er ikke blot den slags carbonhydrider der hedder alkaner. Hvordan kan man se ud fra formlen om stoffet er en alkan?
Ud over alkaner indeholder skibsbrændstof også andre forbindelser herunder aromatiske forbindelser, svovlforbindelser og nitrogenforbindelser. Når stofferne brændes af i motoren, udledes derfor en hel del andre stoffer end carbondioxid og vand. Derfor er skibsbrændstof mere forurenende end andre brændstoffer. Ved ufuldstændige forbrændinger dannes også frit carbon i form af små sod- partikler. Derved bidrager forbrænding af skibsbrændstof også til partikelforurening.
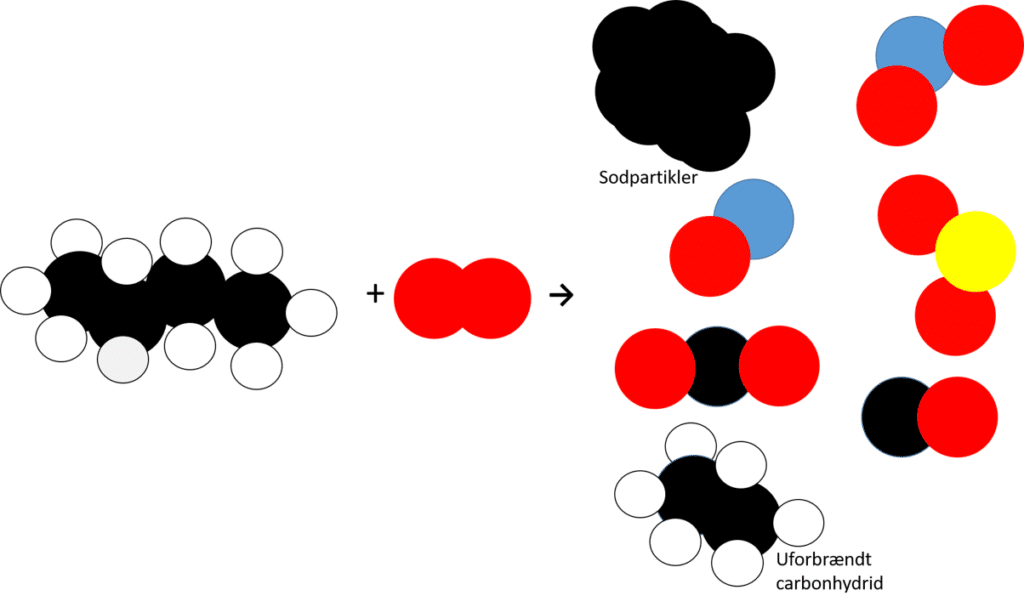
c) Kig på modellen ovenfor. Hvad symboliserer modellen?
d) Hvordan kan du se, at det er en model, og ikke et ’rigtigt reaktionsskema’ for en forbrænding af skibsbrændstof?
e) Navngiv nogle af stofferne i modellen figur 16.
f) Brug modellen til at argumentere for at reaktionen er en ufuldstændig forbrænding og en reaktion af typen redoxreaktioner, inddrag oxidationstal i din forklaring.
Se mere
Ud over methanol, kan methan ligeledes dannes ved Power-to-X.
Også methan (CH4), der er den simpleste alkan, kan benyttes som energikilde til opvarmning af vores huse. Methan er en gas, og er det primære indholdsstof i naturgas. Selvom naturgas lyder meget naturligt, er det vigtigt at forstå, at det er en fossil gas, der ligesom kul og olie er dannet i undergrunden over millioner af år. I dag er hver syvende bolig i Danmark opvarmet med naturgas (ved centralvarme), mens to ud af tre boliger har fjernvarme som opvarmningskilde. Fjernvarme spiller en rolle i udfasningen af fossile opvarmningsformer som naturgas og olie. Fjernvarme er kort fortalt varmt vand fra et kraftvarmeværk, som bliver fordelt til boligerne. I boligerne avendes det varme vand til opvarmning via radiatorerne eller gulvvarme og til at opvarme brugsvand. Derefter løber det retur. Fjernvarmen produceres på forskellige måder med energi fra fx: afbrænding af affald, overskudsvarme fra fx industrien og datacentre, varmepumper, elkedler samt naturgas. I fremtiden kan fjernvarmen også blive baseret på PtX.
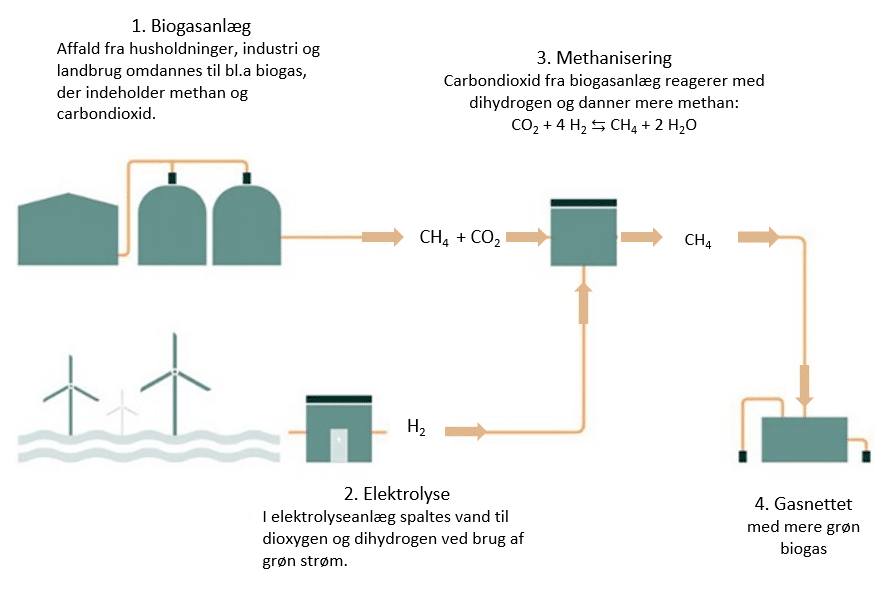
Hvis den biogas, der dannes fra biogasanlæg rundt omkring i landet, kan opgraderes til at indeholde lige så meget methan som naturgas, kan man erstatte naturgassen med den ’opgraderede’ biogas. Energistyrelsen skriver at: ”I opgraderingsanlæg, hvor biogas opgraderes til naturgaskvalitet, frasorteres CO2 og udledes normalt til atmosfæren. Denne CO2 kan med brint gennem ’metanisering’ omdannes til en yderligere mængde e-metan, som kan afsættes på naturgasnettet og fortrænge fossil naturgas.” Dette er vist og omtalt i faktaboksen nedenfor.
dit madaffald, som du formentlig sorterer i en særskilt beholder, omsættes i biogasanlæg, og bliver til el og fjernvarme til fx opvarmning af din bolig?
’Verdenshistorie’ kaldte erhvervsminister Morten Bødskov det, da det danske energiselskab Andel og den globale biogasproducent Nature Energy i 2023 indviede det første anlæg i verden, der på stor skala øger produktionen af biogas via elektrolyse og såkaldt biologisk methanisering.

Vi ser nærmere på hvad der sker kemisk, når methan dannes via elektrolyse og ’biologisk methanisering’. Princippet er vist i figur 18, hvor numre nedenfor henviser til numre på figuren:
Se reaktionsskemaet herunder faktaboksen
Vandet fjernes efterfølgende, og på den måde øges mængden af reaktionsproduktet, methan (Le Chateliers princip).
I anlægget øges mængden af energi ud fra samme mængde organiske affald. Elektrolyseanlægget, kan aktiveres, når der er overskud af vind og sol. Processen er sammenfattet i figur 18
Anlægget i Glansager på Als i Syddanmark, er et resultat af samarbejde mellem bl.a. kemikere på universitetet (bl.a. Syddansk Universitet, SDU), og virksomheder (bl.a. Nature Energy) og startede i et reagensglas i et laboratorium i 2019.

Se mere
CO2(g) + 4 H2(g) ⇆ CH4(g) + 2 H2O(l)
(13)
I produktionen af methan vist i reaktion 13) fjernes vandet efterfølgende, hvorved reaktionen forskydes mod højre. På den måde øges mængden af reaktionsproduktet, methan. Forklar hvorfor reaktionen vil højreforskydes, hvis vand fjernes for reaktionen. Du kan enten bruge Le Chateliers princip i din forklaring eller bruge reaktionsbrøkens størrelse for reaktionen, eller begge argumenter.
Se mere
Både power-to methan, og power-to-methanol forudsætter brug af katalysatorer, der er i fokus i et senere afsnit. I afsnittet Power-to-methanol står omtalt hvordan CO2, indgår som en reaktant, og det indebærer CO2-fangst, ofte omtalt som ’Carbon Capture’, altså fiksering af CO2 . Det omtales ofte som en dekarbonisering.
Nu er man er på vej til også at kunne danne kemikalier fra grøn dihydrogen såkaldte, e-kemikalier, omtalt nedenfor.
7. Hvad er power-to-kemikalier?
Power-to-kemikalier angives ofte som e-kemikalier, og er den gren af kemien, hvor man bruger PtX teknologien og evt. den grønne dihydrogen dannet herfra, til at danne nogle af de kemikalier, vi har brug for i et moderne samfund, vel at mærke, når der er overskud af vedvarende energi, se figur 19.
Emil Drazevic, er lektor på Aarhus Universitet. Han forsker i netop Power-to-Chemicals. Emil udtaler: ”Jeg mener, at Power-to-X kan dekarbonisere den kemiske industri, og en del af den tunge transport. Jeg ser det som den eneste løsning. I dag bruger man 96 % af sort brint i den kemisk industri, og der er et kæmpestor potentiale for at dekarbonisere det via Power-to-X”. Med ’dekarbonisere’, henviser Emil til at carbon fjernes, typisk fra industrielle processer, og med sort brint mener han dihydrogen (i daglig tale brint), der stammer fra fossile brændstoffer.
E-ammoniak (eller power-to-ammoniak), som du har mødt tidligere, er et power-to-kemikalie, da ammoniak er et af de mest brugte industrikemikalier. Det samme er produktionen af hydrogenperoxid nævnt i faktaboksen ’Kemikere som iværksættere, laver grønne og bæredygtige desinfektionsmidler’. E-methanol (power-to-methanol) og e-methan (power-to-methan) er andre eksempler på power-to-kemikalie teknologien. Et andet vigtigt eksempel, er produktion af hvad man kunne kalde et ’byggeklodskemikaliet’, ethen (C2H4). Et ’byggeklodskemikalie’, er et råvarekemikalie, som danner basis for dannelsen af andre kemikalier, der i sidste ende bliver til helt forskellige hverdagsprodukter som fx plast. Ethen er et carbonhydrid, og tilhører stofklassen alkener, pga. carbon-carbon dobbeltbindingen. Ved normal tryk og temperatur er det en gas. Ethen er det vigtigste organiske industrikemikalie, på verdensplan. Det produceres i enorme mængder, hele 134 mio. ton. Ethen indgår i produktionen af plastik, opløsningsmidler, kosmetik, materialer til fx sportsudstyr og meget mere.
Normalt dannes ethen fra fossile brændsler som olie og naturgas, og det skal vi væk fra, siger politikerne. I Danmark er der en ambition om, at være uafhængig af de fossile brændsler – kul, olie og naturgas – i 2050.
Ved at udnytte principperne i elektrolyse, bruges elektrisk energi til at drive produktionen af ethen. Vi ser først på de reaktioner der sker, når carbondioxid ledes ned i vand, og man – via et elektrisk kredsløb, hvor energien kommer fra vedvarende energikilder – kan få reaktion 14) til at forløbe. Et overordnet reaktionsskema kan opskrives således:
2 CO2(aq) + 2 H2O(l) → C2H4(g) + 3 O2(g)
(14)
a) Tegn strukturen af ethen. Hvilke type kemiske bindinger indeholder molekylet?
b) Ethen kan som nævnt dannes fra fossile brændsler, fx ethan. Opskriv et reaktionsskema for denne reaktion.
c) Kig på reaktion 14. Hvilken reaktionstype er det? Hvad er de kemifaglige belæg for det?
d) Tildel oxidationstal til alle atomer i reaktion 14. Antallet af flyttede elektroner er et godt mål for, hvor svær reaktionen er at få til at forløbe.
e) Reaktionen i 14) er ikke spontan, men skal hjælpes på vej fx via elektrolyse. Kan du forklare hvorfor reaktionen ikke er nem at få til at forløbe, med udgangspunkt i dit svar i spørgsmål b ovenfor?
f) Hvilken reaktion forløber naturligt, når carbondioxid gas opløses i vand? Hvad er produktet?
Se mere
et stort ‘Power-to-kemikalie’ anlæg netop (2025) er åbnet i Tyskland? Her anvendes dihydrogen som beskrevet ovenfor, til produktionen af kemikalier som ammoniak og methanol, men også til produktionen af vitaminer?

På samme måde, som man laver elektrolyse af vand, kan man altså lave elektrolyse af carbondioxid opløst i vand. Ligesom i elektrolyse af vand, benytter man et særligt elektrolyseapparat, tilsætter en elektrolyt og tilkobler en strømkilde. Processen koster energi, da der bruges energi til at reducere carbon i carbondioxid til fx ethen. I elektrolysen, sker der en oxidation af vand ved anoden, (som i det forsøg med elektrolyse du selv har lavet), hvorved elektroner frigives. Ved katoden sker der en reduktion af carbon i carbondioxid, under dannelse af ethen, der derved har optaget elektroner:
Katode (- pol):
2 CO2(aq) + 12 H +(aq) + 12 e– → C2H4 (g) + 4 H2O(l)
delreaktion
(15)
Anode (+ pol):
6 H2O(l) → 3 O2(g) + 12 H+(aq) + 12 e–
delreaktion
(16)
2 CO2(aq) + 2 H2O(l) → C2H4(g) + 3 O2(g)
samlet reaktion
(14)
Elektrolyse med carbondioxid er dog en mere kompleks proces, i flere trin og der er flere faktorer, der kan påvirke hvor effektiv, selektiv og stabil processen er. Endnu er man ikke i mål med at gøre processen stabil eller at kunne opskalere processen til brug i industrien. Men processen har store perspektiver for bl.a. CO2 fangst (carbon capture), og grønne kemikalier, som Emil omtalte.
a) Tjek at de to delreaktioner ’katode’ (15) og ’anode’ (16), tilsammen giver den samlede reaktion (14).
b) Elektrolyseprocessen er meget energikrævende. Hvor skal energien komme fra, for at man kan kalde det grøn teknologi?
c) Kig på reaktionsskemaet for elektrolyse af vand. Find ligheder og forskelle med elektrolyse af CO2 vist ovenfor.
Se mere
8. Hvad kan X ellers være?
Ovenfor har du mødt eksempler på hvad X i Power-to-X kan være, fx dihydrogen, methanol eller ethen, som vist i oversigten i figur 20. X kan også være flybrændstof, fx stoffet kerosin. Det kan du høre lidt om i en podcast ‘Grønt brændstof til fly’, lige her med Henrik Wenzel fra Syddansk Universitet.
Der er sikkert mange andre muligheder, hvem ved, måske venter flere nye opdagelser lige om hjørnet? Power-to-? I den grønne omstilling er der behov for kemikere, hvem skal være de nye Power-to-X-perter?
Det er ikke alt man ved i dag inden for kemi. Sådan er det også inden for andre videnskaber. Når man læser en lærebog til gymnasiet, kan det ofte virke som om man ved det hele. Det gør man langt fra. Ellers sagt på en anden måde:

Videnskab, herunder den kemiske videnskab, er ikke bedre end summen af de erkendelser, der er. Disse ændres over tid, da man hele tiden opnår nye erkendelser. Så der er fortsat brug for kreative hjerner til at bidrage til at løse nogle af tidens store globale problematikker. Som eksempelvis at finde nye katalysatorer, som er i fokus i næste afsnit.
Gå sammen i grupper af 2-3. Kom hver især med eksempler på, hvad vi ved – og ikke ved inden for naturvidenskab (helst kemi). Et eksempel kunne være at vi kender atmosfærens sammensætning, men ikke med sikkerhed ved, hvor vand på jorden egentlig kommer fra.
Prøv så godt I kan og accepter at I ikke ved det hele 🙂
a) Kom med eksempler på ’vi ved at vi ikke ved’
b) Kom med eksempler på ’vi ved at vi ved’,
c) Kom med eksempler på ’vi ikke ved at vi ved’
d) Kom med eksempler på ’vi ikke ved at vi ikke ved.
Se mere
9. Speed up – hvorfor har vi brug for katalysatorer?
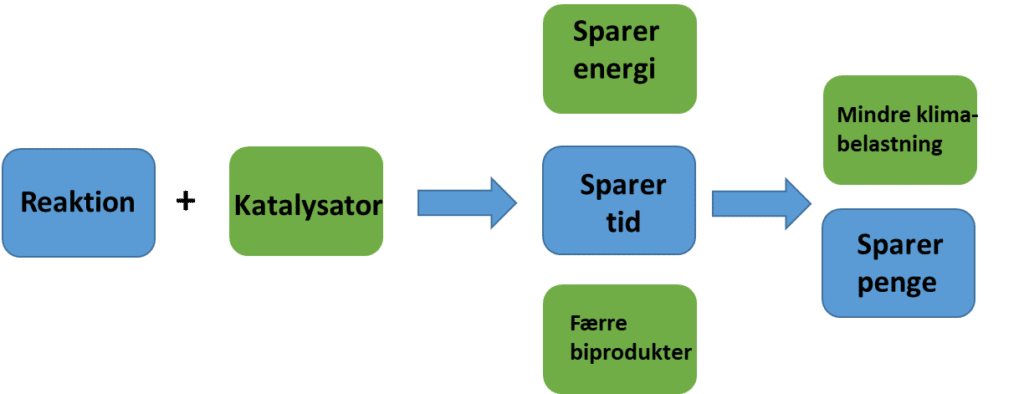
Mere end 90 % af al produktion, både produktionen af lægemidler, tekstiler, brændstoffer, kemikalier mm. kræver brug af katalysatorer. Det viser, hvor central viden om katalysatorer er, og derfor går udvikling af nye energimaterialer, brændstoffer og kemikalier hånd i hånd med udviklingen af nye katalysatorer.
En katalysator er et stof, der øger reaktionshastigheden for en kemisk reaktion uden selv at blive forbrugt. Grunden til at vælge at bruge en katalysator er opsummeret i figur 21. Som det fremgår af figuren, er brug af katalysatorer en del af den grønne omstilling:
Også inden for bioteknologien og biologien, forudsætter langt de fleste reaktioner katalyse (v.hj.a enzymer). Lad os se på hvordan en katalysator virker. Figur 22 er et billede på en katalysators rolle.
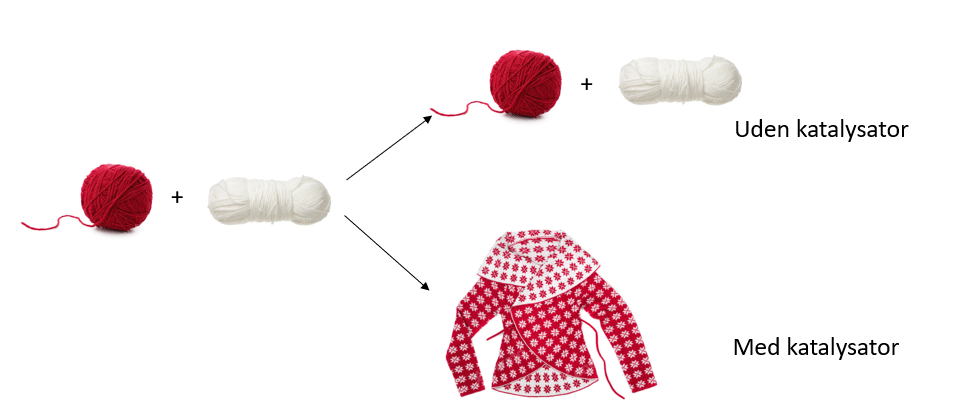
Kig på figur 22 og forklar hvad der er katalysator i reaktionen. Lever det op til definitionen af en katalysator: ‘et stof, der øger reaktionshastigheden for en reaktion uden selv at blive forbrugt’?
Se mere
Reaktionshastigheden for en kemisk reaktion øges ved, at katalysatoren skaber en anden reaktionsvej, når reaktant skal omdannes til produkt. Forestil dig din skolevej til gymnasiet. Højdeforskellen (højde over havets overflade) mellem dit hjem og gymnasiet er den samme uanset hvad du gør, men der findes fx forskellige måder at komme frem. På samme måde som med katalysatoren i en kemisk reaktion, kan din cykel sørge for, du lettere kommer til skole, så du måske kan sove lidt længere og stadig kommer frem i tide.
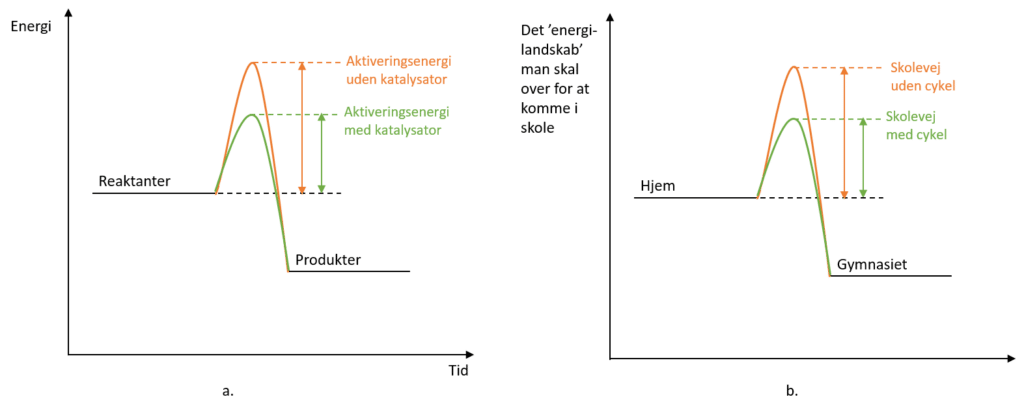
Som det fremgår af figur 23, er aktiveringsenergien mindsket, når der anvendes en egnet katalysator, men energiforskellen mellem reaktant og produkt er den samme. Det er, fordi det er reaktionsvejen, der ændres, ligesom ’skolevejen’ i eksemplet oven for (på kemisprog kinetikken), mens forskellen i potentiel energi mellem reaktant og produkt ikke ændres, altså at højdeforskellen mellem hjem og gymnasium i eksemplet er den samme.
I en kemisk reaktion kan en katalysators virkning eksempelvis være at hjælpe med at orientere molekylerne, så de oftere rammer hinanden korrekt.
Katalysatoren virker altså generelt ved at sænke aktiveringsenergien, så der er flere af molekylerne, der har tilstrækkelig med kinetisk energi til et succesfuldt sammenstød, hvorved reaktanter omdannes til produkter, som illustreret i figur 24.

Når man vælger en katalysator, skal man sørge for, at katalysatoren er meget effektiv, at den er modstandsdygtig over for skrappe reaktionsbetingelser, som store udsving i temperatur og tryk, sure eller basiske opløsninger, og at den kan holde til at blive brugt igen og igen over en lang periode. Herudover skal den gerne være billig og ikke til skade for miljøet. Nogle katalysatorer er specifikke, som fx enzymet pepsin vist i figur 25, mens andre katalysatorer ikke er specifikke nok, det gælder for mange faststof-katalysatorer nævnt i næste afsnit. Så en god katalysator for én reaktion er ikke nødvendigvis en god katalysator for en anden reaktion Når man har fundet en række katalysatorer, man har en formodning om, kan være gode, skal de testes i laboratoriet. Først i lille skala og så i større skala.
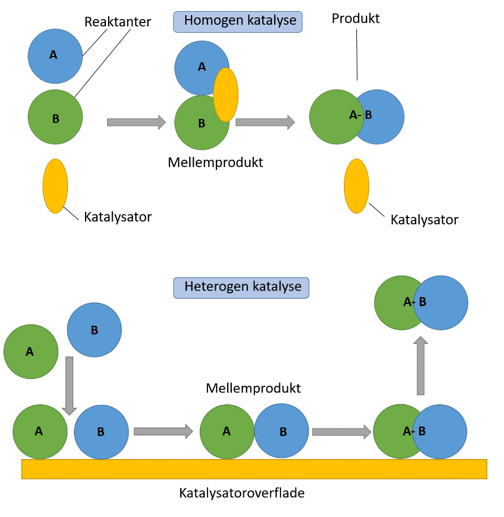
Når en katalysator skal udvælges, spiller det en rolle, om katalysatoren skal være på samme tilstandsform som reaktanterne. Hvis den er det, kaldes den katalyserede reaktion for en homogen katalyse. Omvendt gælder det, at hvis katalysatoren er på en anden tilstandsform end reaktanterne, så kaldes det for heterogen katalyse. Læg mærke til, at selve katalysatoren ikke kan kaldes for homogen eller heterogen katalysator, fordi det afhænger af tilstandsformerne i selve reaktionen.
Katalytiske processer kan altså være heterogene eller homogene. Katalysatoren skrives som regel over reaktionspilen for at vise, at den er en del af reaktionen uden selv at blive forbrugt. Hvis der er nogle bestemte forsøgsbetingelser i en reaktion, skrives de som regel under reaktionspilen, som vist i eksemplet med ammoniak fra Haber-Bosch processen:
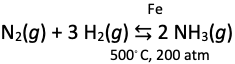
(8)
Eksempler på homogen katalyse er, når både reaktant og katalysator er på væskeform. Det kan fx være når svovlsyre (H2SO4), katalyserer syntesen af acetylsalicylsyre (et lægemiddel), eller når biologiske katalysatorer, enzymer, katalyserer biokemiske reaktioner. Det er illustreret i figur 25.

I heterogen katalyse er katalysatoren typisk et fast stof, mens reaktanten er på væske- eller gasform, som vist i reaktion 8).
Den eneste forskel på homogen og heterogen katalyse er altså, om tilstandsformerne er den samme for reaktanter og katalysator eller ej. Ligheden er, at reaktanterne binder til katalysatoren, der optimerer orienteringen af reaktanterne og hjælper med at bryde og danne bindinger, som illustreret i figur 26.
Eksemplet med heterogen katalyse nedenfor, omhandler ammoniakproduktion.
Eksempel på heterogen katalyse
Haber-Bosch reaktionen (8) danner som sagt ammoniak fra dinitrogen og dihydrogen.
Se reaktionsskema nedenfor.
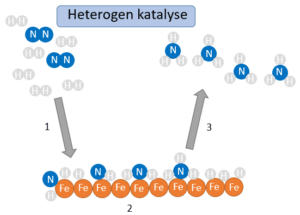
Figur 27 illustrerer, hvordan jern kan katalysere reaktionen. Jernkatalysatoren binder dihydrogen og dinitrogen, hvorved bindingerne indbyrdes i molekylerne brydes og binder til katalysatoren i stedet for. Herefter sættes ét hydrogenatom på nitrogenatomet ad gangen, til alle tre sidder bundet, og ammoniakmolekylet slipper katalysatoren, der så kan binde nye reaktanter. I praksis omdanner katalysatoren dog mange reaktanter ad gangen.
Se mere
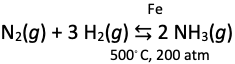
(8)
Kig på figur 27, og forklar hvad der sker i trin 1, 2 og 3 på figuren. Gør jer umage med at få nogle faglige forklaringer med.
Se mere
Induktivt elevforsøg med heterogen katalyse.
Øvelsesvejledning ligger under fanen ’Eksperimenter’.
Udvikling af nye og effektive katalysatorer anses for at være en af nøglerne til en grøn omstilling.
Nedenfor har vi fokus på, hvordan heterogen katalyse øger reaktionshastigheden for elektrolysen af vand, elevforsøget du har lavet tidligere. Her dykker vi lidt ned i den underliggende ’reaktionsmekanisme’, som vi så i eksemplet med ammoniakproduktionen ovenfor.
Som du så i dit eget forsøg med elektrolyse af vand, kræves elektricitet til spaltningen af vand. Der bruges meget energi hertil, da det kræver et overpotentiale (se ovenfor), men ved at benytte en katalysator, kan man lave ’en genvej’. Elektrolysen af vand består af to delreaktioner oxidation ved anoden og reduktion ved katoden. Når forsøget med elektrolyse opskaleres til større skala i industrien, er hver delreaktion i elektrolysen katalyseret af en specifik katalysator, se figur 28. Her benyttes faste katalysatorer og katalysen er derfor heterogen. Ligesom i elevforsøget, sker elektrolysen i sur væske.
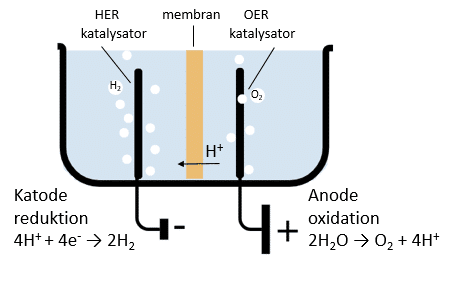
1) Samlet reaktion 2 H2O(l) → O2(g) + 2 H2(g)
a) Anoden (+) OER katalysator: 2 H2O(l) → 4 H+(aq) + 4 e– + O2(g)
b) Katode (-) HER katalysator: 4 H+(aq) + 4 e– → 2 H2(g)
Før du læser videre, skal du tjekke at delreaktioner a og b tilsammen giver den reaktion 1)
Katalysatoren i a og b er forskellige. Ved anoden benyttes en OER katalysator, der står for ’Oxygen Evolution Reaction’, på dansk oxygenudviklende reaktion, mens katalysator ved katoden kaldes HER katalysator, for ’Hydrogen Evolution Reaction’, på dansk hydrogenudviklende reaktion.
Vi ser nu nærmere på a):
OER-katalysatorens overflade består ofte af metallet iridium (Ir) bundet med oxygen i et oxid, som iridiumoxid IrO2. Ved anoden oxideres vand og mekanismen er som vist i figur 29:
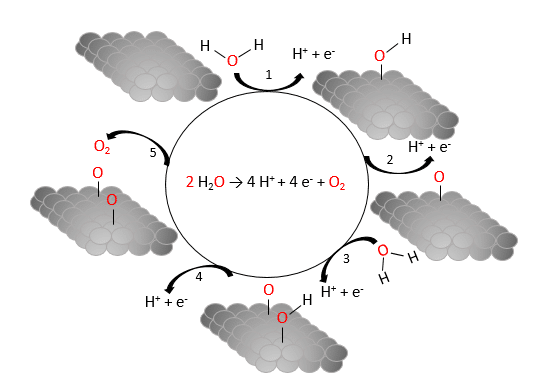
To vandmolekyler frigiver i alt fire hydroner og fire elektroner i elektrolysen. Som vi så tidligere, sørger den ydre strømforsyning for at bringe elektronerne væk fra anoden og over mod katoden, mens de positive hydroner bevæger sig mod negative elektrode (katoden), da membranen vist på figur 28 er gennemtrængelig for hydroner.
Efter reaktionen kan katalysatoren katalysere spaltningen af nye vandmolekyler.
Vi ser nu nærmere på hvad der sker i delreaktion b:
b) Katode (-) HER katalysator: 4 H+ (aq) + 4 e– → 2 H2 (g)
Ved katoden reduceres hydronerne, hvorved der dannes dihydrogen. Katalysatoren til delreaktion b, HER katalysatoren, består typisk af metallet platin (Pt). I et metal sidder atomerne i et metalgitter og er kendetegnede ved, at elektronerne (valenselektronerne, elektroner i yderste skal) er delt ud mellem atomerne (det kalder vi, at elektronerne er delokaliserede). Valenselektronerne kan altså bevæge sit frit gennem metallet. De delokaliserede valenselektroner holder de positivt ladede metalatomer sammen i metalgitteret. Bindingstypen hedder en metalbinding. Mekanismen for katalysen ved katoden er, som vist i figur 30.
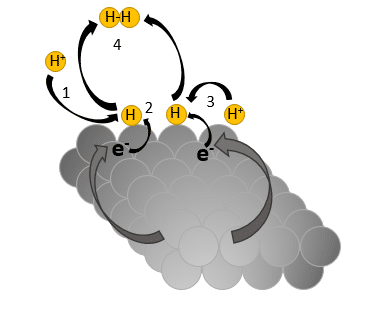
Elektronerne, der er afgivet, bringes atter tilbage.
Strukturen særligt på overfladen af katalysatoren bestemmer katalysatorens egenskaber, da det ofte er på overfladen, at de katalytiske reaktioner finder sted.
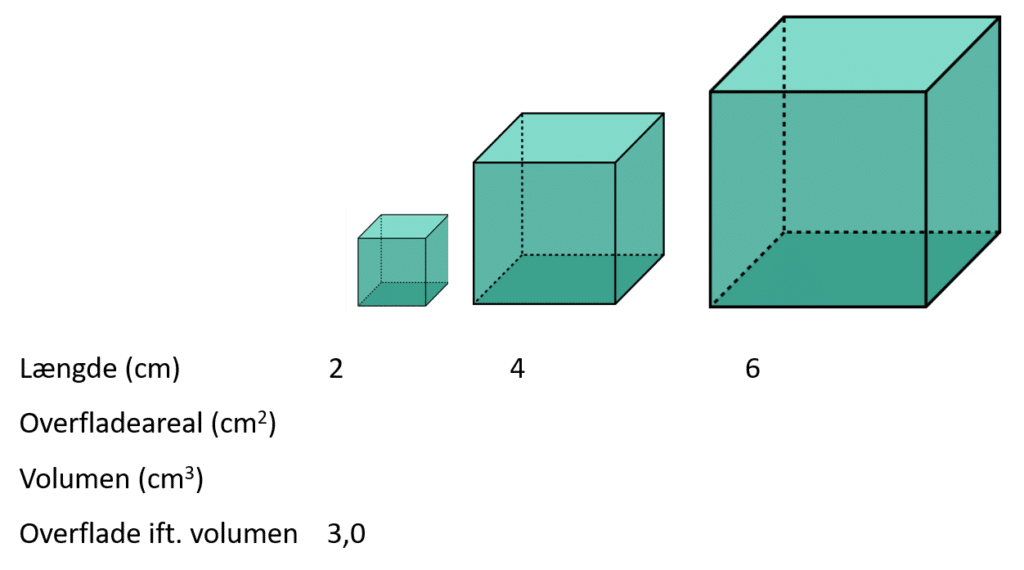
Som vi skal se nedenfor, er faststof-katalysatorerne ofte ultrasmå (på nanometer skala), så de får en større overflade ift. volumen.
Se mere
a) Beregn de manglende data for hhv. overfladeareal, volumen og overflade ift. volumen fra 31.
b) Forklar hvorfor det er sådan, at små katalysatorer har større overfladeareal ift. volumen, og hvilken betydning, det kan have i heterogen katalyse.
Se mere
Ud over at lave katalysatorerne små, hvilke andre greb kan man benytte til at lave mere effektive katalysatorer i fremtiden? Kom med nogle konkrete bud. Snak med en anden gruppe og sammenlign jeres bud.
Se mere
Alle PtX reaktioner kræver en katalysator, så udviklingen af nye og bæredygtige kemikalier og brændstoffer, kræver udvikling af nye katalysatorer. Teoretiske kemikere er centrale i udviklingen af ny kemi, herunder nye katalytiske materialer. De bruger kvantemekanik, kombinatorik, kemiske beregninger og Machine Learning.

I stedet for at tilbringe tiden i laboratoriet, regner teoretiske kemikere på kemien. Derudover udvikler de selv nye beregningsværktøjer til at hjælpe i jagten på nye materialer. En analogi til den teoretiske kemikers rolle fra vores hverdag er, hvis vi skal bygge et hus. Der ligger en hel række vigtige beregninger forud, før håndværkerne går i gang med at bygge huset, så man sikrer, at konstruktionen er den rigtige og faktisk kan holde, før man bygger.
På samme måde regner de teoretiske kemikere sig frem til, hvilke materialer der skulle være de bedste katalysatorer. Hertil bruger de kvantemekanik, men får også hjælp fra Machine Learning, der baserer sig på en algoritme, der er trænet med både eksperimentelle data og teoretiske værdier (kvantemekaniske data).

På Kemisk Institut, Københavns Universitet arbejder Jan Rossmeisl og Kirsten M.Ø. Jensen sammen i centeret CHEAC (Center for High Entropy Alloy Catalysis). Her forsker de i den næste generation af katalysatorer, som er en forudsætning for fremtidens grønne kemikalier og grønne brændstoffer.
Centeret består af både forskere og studerende, der arbejder sammen om at identificere vigtige ’nøgle-reaktioner’ i den grønne omstilling. Hypotesen er, at de ideelle katalysatorer er såkaldte ’ High Entropy Alloys’, på dansk ’høj-entropi-legeringer’. Det er metal-legeringer, altså ensartede blandinger af (sammensmeltede) grundstoffer, typisk metaller. Du kender princippet fra messing, bronze og stål, der alle er legeringer.
Katalysatorer der er ’høj-entropi-legeringer’, består af mere end 5 forskellige metaller. Disse metaller er hver især tilfældigt fordelt i hele katalysatoren. Til sammenligning består konventionelle katalysatorer typisk kun af et enkelt grundstof, tilsat et eller få andre grundstoffer i ganske små mængder, se figur 32.

Som vist på figur 32 sidder atomerne i en høj-entropi-legering ofte i samme krystalstruktur som et almindeligt metal, men de forskellige grundstoffer er tilfældigt fordelt. Forskning viser, at der er en slags ’cocktail effekt’ altså en synergistisk effekt, så blandingen af de forskellige metaller er bedre end summen af de indgåede metaller. Denne effekt hænger sammen med den helt specielle struktur, der findes på overfladen af høj-entropi-legeringer. Sammenlignet med almindelige katalysatorer, består overfladestrukturen af høj-entropi-legeringer af mange forskellige ’miljøer’, som hver især har forskellige egenskaber. Blandingen af fem grundstoffer skaber millioner af mulige overflade-miljøer, og derved er disse katalysatorer helt forskellige fra de mere ensartede overflader vi finder i konventionelle metalkatalysatorer. Overfladestruktur spiller en stor rolle i heterogen katalyse, da det er overfladen, der vekselvirker med de molekyler, der indgår i PtX-processer.
Den specielle struktur af høj-entropi-legeringer indebærer ’at vi måske skal ændre på forståelsen af katalyse’, som Jan Rossmeisl formulerer det. Det viser, hvordan grundforskning (forskning i helt basale områder), går hånd i hånd med anvendt forskning, hvor kemi anvendes i løsningen af et problem. Fokus ændres fra at bruge de materialer, vi har, til af udvikle de materialer vi har behov for. Derudover kommer et nyt benspænd ind: at skele til hvilke grundstoffer, der kan benyttes bæredygtigt.
På centret CHEAC bruger de teoretiske modeller og algoritmer til at forudsige, hvilke metaller der kan kombineres til de nye katalysatorer, og hertil analyserer de bindingsenergier (den energi der skal bruges til at bryde en kemisk binding), ved binding af gas og væsker til katalysatoren. De udvikler en slags designprincipper for denne type katalysatorer, hvor kombinatorik også spiller en rolle. Jan Rossmeisl fortsætter: ’Man kan sige det ganske enkelt. Med en mere effektiv katalysator, skal vi bruge færre vindmøller til at lave den samme mængde grønt brændstof. Hvor effektiv elektrokatalysen er, afhænger bl.a. af det materiale, som katalysatoren består af.
De katalysatorer, der udvikles på CHEAC, er typisk nanomaterialer. Nano er en størrelsesbetegnelse, og nanometer betyder 10-9 m, så 1 nanometer = 0,000000001 m. Nanomaterialer har blandt andet et meget stort overfladeareal, og netop overfladeareal er jo vigtigt i forbindelse med udvikling af nye katalysatorer.
Eksperimentelle kemikere, Kirsten M.Ø. Jensen
Nu skal de eksperimentelle materialekemikere undersøge om man kan syntetisere de foreslåede katalysatorer i kemilaboratoriet og hvordan man laver det. Herefter udfører de selv synteserne, og den efterfølgende karakterisering at materialet, indbefatter bestemmelse af materialets struktur.
Du skal møde Kirsten M.Ø. Jensen, som omtalt ovenfor. Som ung ville hun læse kunsthistorie eller spille klassisk musik. Men det blev kemien og arbejdet med atomare strukturer og nanomaterialer, der vandt. Ifølge Kirsten er der ikke den store forskel på kunst og naturvidenskab. Det handler om at se verden fra nye vinkler og tænke anderledes. Hun er en af de talentfulde kvindelige forskere på verdensplan, der er hædret med den internationale pris ’International Rising Talent’.

Kirsten er eksperimentel materialekemiker og hendes forskningsgruppe planlægger, undersøger, syntetiserer og karakteriserer de materialer, der skal bruges i katalysatorerne til den grønne omstilling. Hun arbejder inden for konceptet ”Materials by Design”. Ved at forstå sammenhængen mellem atomar struktur og materialeegenskaber, kan de eksperimentelle kemikere skræddersy nye materialer med de egenskaber, der skal bruges. Som Kirsten siger ’det er materialerne, der er tilgængelige, der dikterer hvordan vi lever’, som vi har set i de historiske perioder jernalder, stenalder og bronzealder og stål der startede industrialiseringen.
Kirsten og hendes forskningsgruppe arbejder med at forstå sammenhængen mellem stoffers struktur, egenskaber og den måde stoffernes syntetiseres på. De undersøger stoffernes struktur, og er helt nede og kigge på enkelte atomer og deres organisering i en krystal, dvs. på atomart niveau.
I kemilaboratoriet fremstilles de metallegeringer, som er foreslået af de teoretiske kemikere. Herefter skal stoffets struktur undersøges, er deres struktur og egenskaber som forventet, og er det de rigtige stoffer der er blevet dannet? Røntgenstråler kan bruges til at ’se’ atomer med, da røntgenstrålers bølgelængde er på niveau med atomernes størrelse. Kirstens gruppe bruger røntgenstråling i deres karakterisering for at undersøge, om stofferne har den struktur og de egenskaber, man havde forudsagt. Teknikken hedder røntgendiffraktion.
Vi afslutter temaet her, med at se på et af gruppens forskningsprojekter, med nanopartikler til brug i katalysatorer. Partiklerne er ’høj entropilegeringer’, og indeholder de fem forskellige metaller: platin (Pt), jern (Fe), cobalt (Co), nikkel (Ni) og palladium (Pd), fordelt i små nanopartikler. Disse nanopartikler som PtFeCoNiPd, kan efterfølgende benyttes i faststof-katalysatorer og bruges til at katalysere reduktion af oxygen-gas til oxid-ioner (Oxygen Reduction Reaction (ORR)). Katalysatorerne viser sig lovende i den grønne omstilling, fx i brændselsceller, til elektrokatalyse, hvor dioxygen (O2) skal reduceres til vand.
PtFeCoNiPd nanopartikler dannes i laboratoriet gradvis fra et metalchlorid salt, vist i figur 33a. Her ses strukturen af et salt, dvs. et krystallinsk materiale bestående af de positive ioner Fe2+ og Pt2+, og de negative ioner Cl–, i krystallen er også bundet vand. Den mindste enhed af saltet er vist (en såkaldt enhedscelle). De andre metaller kan endnu ikke ses i strukturen. Saltet er et udgangsstof, da det blot er starten på dannelsen af selve nanopartiklen. Derefter behandles saltet i en reducerende atmosfære og ved stigende temperaturer, hvorved metal-ionerne reduceres til metal (fra et positivt oxidationstal til oxidationstal på 0), og krystalstrukturen ændres og nanopartiklerne dannes. Ved gradvis at øge temperaturen til over 350 ◦ C, fremkommer en krystalform, hvor metallerne er ordnet i lag, og hvor både ædelmetallerne Pt og Pd er inkorporeret sammen med de andre overgangsmetaller Ni, Co og Fe, som vist i figur 33b, igen er vist den mindste enhed partiklen består af. Så der er orden i uordenen når nanopartiklen PtFeCoNiPd dannes som vist i 33.c, det ses ved lagdeling i strukturen. Selvom nanopartiklen måske ser stor ud på figur 33 c, har den blot en diameter på 10-100 nm. Strukturen er som omtalt ovenfor, studeret ved brug af teknikken røntgendiffraktion.
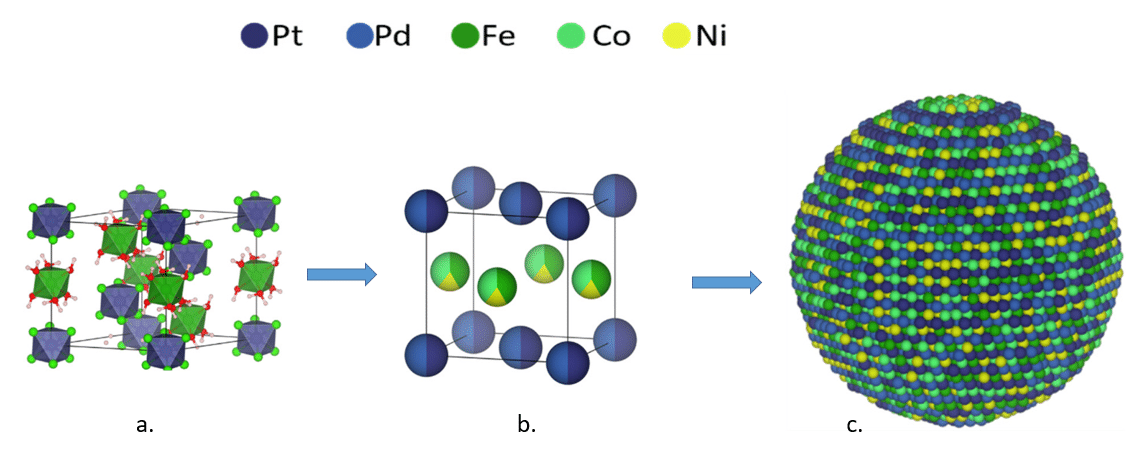
Nanopartiklerne er dannet direkte på en fast overflade bestående af carbon, og kan nu anvendes i katalyse.
Hvis du vil have Kirstens forklaring af nanoskala, materialekemi og røntgenstråler til undersøgelse af materialer, kan du se et klip med Kirsten, hvor hun giver ’et røntgenblik ind i materialekemien’.
Se mere