1. Alt er kemi
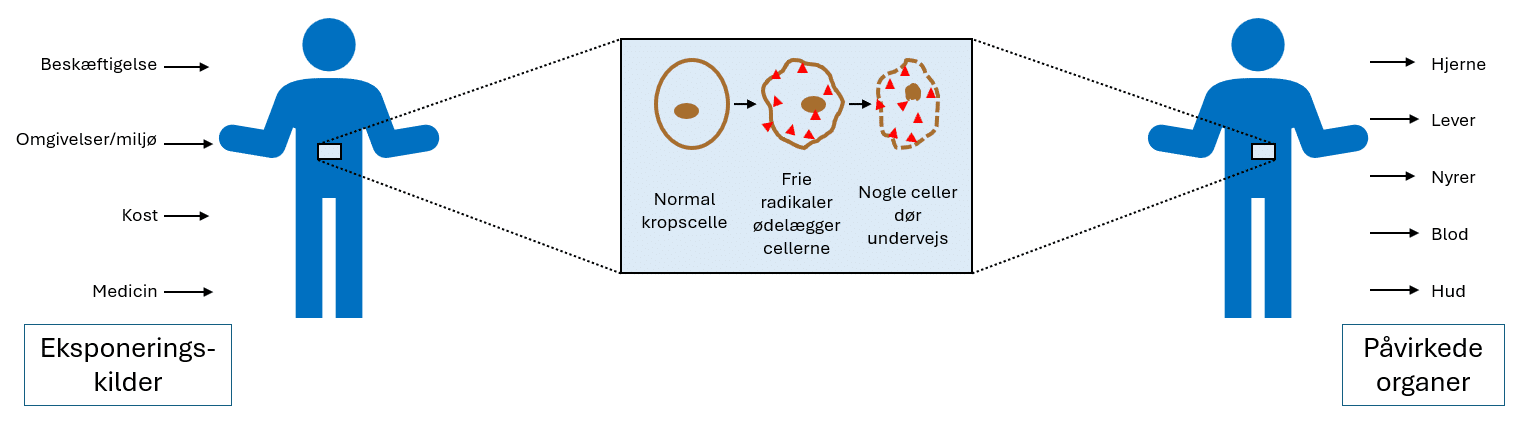
Alting omkring dig er kemi. Grundstofferne indgår i alt omkring dig, bordet du sidder ved, din computer, luften du indånder, og dig selv. Grundstofferne er byggestenene til alt, og de styrer alle de processer, vi oplever: fx plantevækst, stofskifte, sanseindtryk, forelskelse, og geologiske processer. Grundstofferne bestemmer egenskaberne af alle de materialer, vi endnu ikke har opfundet, såvel som dem vi ser og benytter fx proteiner, sukre, batterier, stærke magneter og superledende materialer, forklarer professor i kemi på Københavns Universitet, Jesper Bendix.
Gå sammen 2 og 2 eller 3 og 3. Gennem en fotosafari skal I tage fotos af jeres omgivelser. I bør både tage fotos i klasselokalet og gå ud på en udendørs fotosafari. Bagefter skal I samle jeres fotos i et dokument (I kan nøjes med 8-10 fotos, så er I med på princippet) og undersøge, hvad det I ser på billedet består af og hvilke grundstoffer der indgår.
Vi ser først på et eksempel.
Prøv så godt I kan, det vigtige er ikke at komme frem til det helt korrekte svar, men at være nysgerrig på, hvad alt består af og hvilke grundstoffer, der indgår.
Måske kender I selv svaret, ellers kan I benytte jer af internettet, eller evt. spørge jeres lærer.
| Ting: | Bestanddele: | Grundstoffer |
| Bord | Træbordplade og metalben | træ: hovedsageligt C, H og O,
ben: forskellige metaller, formentlig jern (Fe) eller aluminium (Al). |
Se mere
Nu har du undersøgt lidt om, hvordan alting omkring dig er kemi. Jo mere vores samfund er blevet udviklet, des flere forskellige grundstoffer gør vi brug af. I takt med at mange lande oplever øget velstand, øges forbruget. Så hvordan sikrer vi, at fremtidige generationer også har adgang til de ressourcer, der måtte være brug for? Det er i fokus i afsnit om bæredygtighed.
2. Bæredygtighed
Bæredygtighed er et bredt begreb, der både vedrører miljøet, det sociale og det økonomiske i samfundet, som illustreret i figur 1. Bæredygtighed tager udgangspunkt i menneskets behov. En bæredygtig udvikling bør opfylde de nuværende behov vi mennesker har, uden at bringe fremtidige generationers muligheder for at opfylde deres behov i fare.
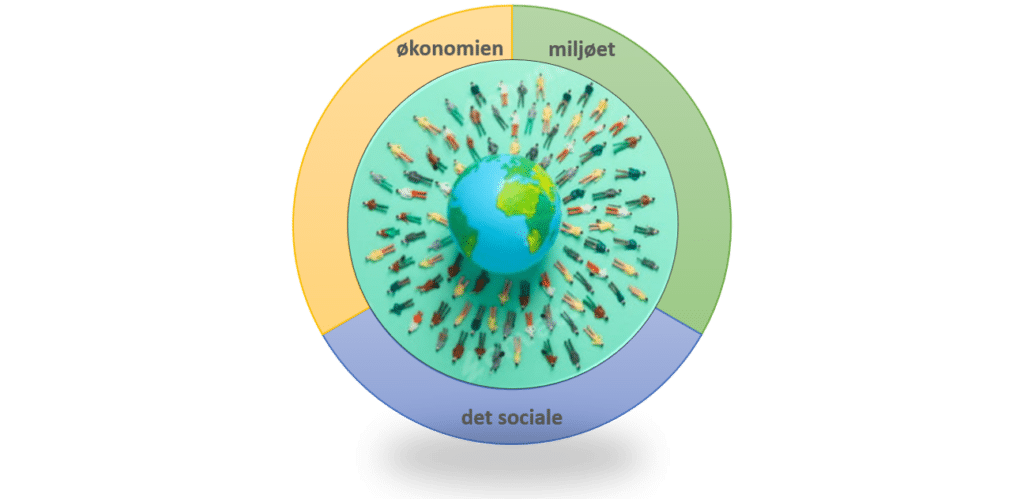
I temaet ’Grundstoffer og bæredygtighed’ er der fokus på det miljømæssigt bæredygtige. Men også den sociale og den økonomiske del af bæredygtigheden kommer i spil, fx når vi skal se på, hvordan nogle grundstoffer udvindes ved minedrift forskellige steder i verden.
For vi skal have mere fokus på bæredygtighed, når vi i fremtiden skal udvinde endnu flere forskellige grundstoffer til brug i batterier, elbiler, solceller, mobiltelefoner eller til magneter i vindmøllerne. Læg mærke til, at grundstoffer hverken er bæredygtige eller ej i sig selv, men brugen af grundstofferne kan være mere eller mindre bæredygtig. Man kan sige, at viden skaber bæredygtighed. Når vi er opmærksomme på problemerne, kan vi skabe bæredygtige løsninger.
3. Grundstoffer
Figur 2 viser udvalgte grundstoffer og kemiske forbindelser.

Et grundstof består af ens atomer, som fx ikke metallet svovl (S), eller metallet guld (Au). Grundstoffer har alle samme antal protoner i atomkernen. Antallet af neutroner kan variere, hvilket giver forskellige isotoper (isotoper er forskellige udgaver af det samme grundstof. Isotoper har samme antal protoner, men forskelligt antal neutroner og derfor forskellige atommasser.)
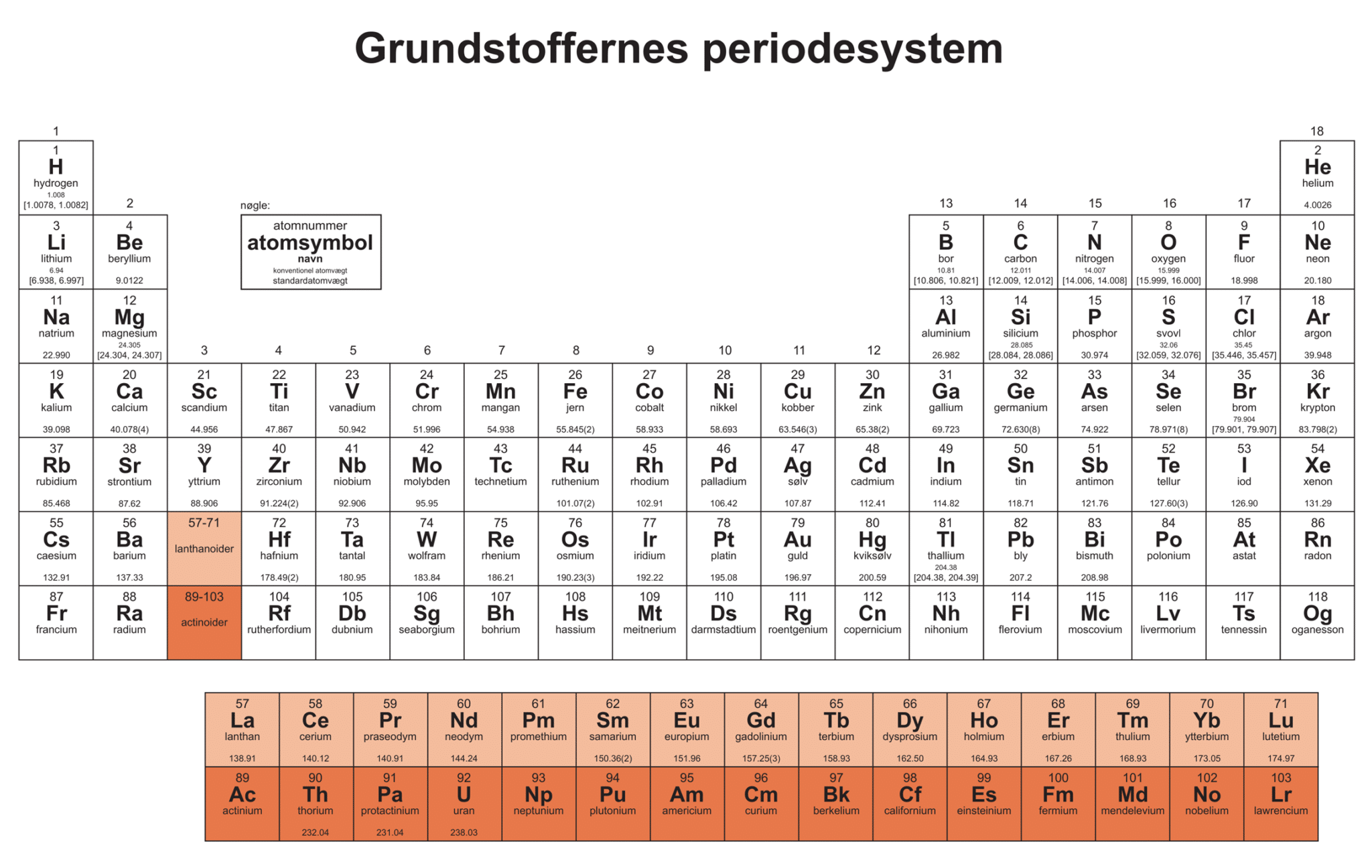
Antallet af protoner svarer til atomnummeret og angives sammen med atomsymbol og navn i grundstoffernes periodiske system. Atomsymbolet er et eller to bogstaver, hvis det er to bogtaver skal andet bogstav være et lille bogstav. Dette er illustreret i figur 3.

Senere i temaet lærer du, hvordan elektronerne fordeles i skaller omkring atomkernen. Elektronerne i de yderste skaller er dem, der er involveret i kemiske reaktioner. Kender du elektronfordelingen for et atom, kan du også forudsige atomets reaktivitet – altså om og hvordan det vil reagere med andre atomer. Du lærer også, hvordan atomets masse angives.
Først skal vi undersøge grundstoffernes periodiske system, der i dag inkluderer hele 118 forskellige grundstoffer. Du skal lære grundstofferne og det periodiske system lidt nærmere at kende, så du kan have forståelse for, hvilke grundstoffer vi bør undgå at anvende og hvilke vi med fordel kan anvende i jagten på grundstoffer til grønne brændstoffer.
I jagten på nye, mere grønne brændstoffer til fx fly og containerskibe, er det op til dig at udvælge grundstofferne. Opgaven inddrager ikke overvejelser om kernekraft. I undersøgelsen her skal du kombinere navnet på grundstoffet, atomsymbolet og udsagnet og undervejs strege grundstofferne fra listen, efterhånden som de udelukkes som bestanddel i grønt brændstof.
Men først skal du selv i gang:
Kig på grundstoffernes periodiske system (du findet et nederst i opgaven), og skriv ned hvilke grundstoffer, du mener, man nok bør undgå at bruge i bæredygtige brændstoffer. Vi vender tilbage til dette sidst i opgaven.
Nogle grundstoffers navne er danske, og så det er ikke altid helt let at gætte sig frem til atomsymbolet. Fx har grundstoffet kviksølv atomsymbolet Hg, som er forkortelsen for grundstoffets græske navn, hydrargyrum.
Du kan få teksten oplæst ved at markere teksten og trykke ‘Oplæs markering’. Undervejs streges atomsymbolet fra grundstoffernes periodiske system, når det angives.
Hvilke grundstoffer skal vi satse på til fremtidens bæredygtige brændstoffer og hvilke bør vi udelade? Lad os komme i gang og finde ud af det!
Der er i dag 118 grundstoffer samlet i det periodiske system. Heraf er de 30 grundstoffer syntetiske (dvs. kunstige), og forekommer ikke naturligt på jorden, men er dannet kunstigt, altså syntetiseret. Det sker oftest i en atomreaktor eller en partikelaccelerator. De syntetiske grundstoffer kan også dannes i eksplosionen fra en atombombe, så at lave et kunstigt grundstof er ikke ligefrem nemt! ”De grundstoffer, vi kalder syntetiske, er ustabile, henfalder og bliver med tiden til andre grundstoffer,” påpeger Anders Døssing, lektor på Kemisk Institut ved Københavns Universitet. Technetium er det første syntetiske grundstof, der blev fremstillet. Først senere fandt man ud af, at der faktisk findes uhyre små mængder af stoffet naturligt. Stoffet er radioaktivt, men kan fremstilles i rimelige mængder og har en så lang halveringstid at det kan bruges til noget, fx til at diagnosticere kræft. Grundstoffet curium blev det første syntetiske grundstof, der slet ikke findes naturligt på jorden. Alle syntetiske grundstoffer er radioaktive, og de radioaktive grundstoffer ser vi på om lidt. Slet technetium og curium, og udeluk resten af de syntetiske grundstoffer: promethium, astat, francium, og hvad man kalder transuranerne, som er grundstofferne, der har højere atomnummer end uran i det periodiske system. Curium, du netop har slettet tilhører også transuranerne. Det er nemlig ikke bæredygtigt at anvende syntetiske grundstoffer i de grønne brændstoffer.
Sæt afspilningen på pause indtil du finder grundstofferne i det periodiske system, og har streget dem (senere omtalt blot som ’pause’).
Når de syntetiske grundstoffer er trukket fra, er der 88 tilbage. Alle grundstoffer i det periodiske system har isotoper, altså udgaver af samme grundstof, hvor antallet af neutroner i kernen varierer. Grundstoffer med atomnummer højere end 20, har normalt isotoper med ustabile atomkerner, hvor atomkernen ikke er bundet stærkt nok sammen til at være stabil . En ustabil atomkerne er radioaktiv, udsender radioaktiv stråling og henfalder. Hele 36 grundstoffer har ikke nogen stabile isotoper. Mange af dem har du allerede udelukket, da de er syntetiske grundstoffer. Af de 88 grundstoffer du har tilbage som muligheder, skal du trække syv fra, da de er naturligt forekommende og radioaktive.
Uran forbinder vi normalt med atomkraftværker, bomber og sundhedsfare. Men også andre radioaktive grundstoffer kan være sundhedsskadelige, hvis vi udsættes for dem i større mængder. Det blev opdaget kort efter, at grundstofferne selv blev opdaget. Marie Curie, der opdagede de radioaktive stoffer polonium og radium sammen med sin mand Pierre, endte med at dø af en strålingsrelateret sygdom, fordi hun havde været udsat for en stor dosis radioaktiv stråling fra stofferne. Marie Curie var den første kvindelige nobelprismodtager, og den første person, der har modtaget nobelprisen to gange. Grundstoffet polonium er senere blevet berømt og berygtet bl.a. i 2006, da den tidligere russiske systemkritiker Alexander Litvinenko, blev snigmyrdet med en mikroskopisk lille dosis af den radioaktive isotop polonium-210 (210Po) i sin te.
Udeluk de naturligt forekommende radioaktive grundstoffer, det går ikke at fylde radioaktive brændstoffer i fx flymotoren. Streg derfor både uran og polonium, samt actinium, thorium, radon, radium og protactinium, så du har 81 grundstoffer tilbage.
For at danne brændstoffer skal de indgående grundstoffer kunne deltage i en kemisk reaktion. Derfor duer ædelgasserne, som vi kalder gruppe 18, ikke. Ædelgasserne er ’dovne’ og vil nødigt reagere med andre grundstoffer. Det udnyttes fx når ædelgassen argon, der forekommer naturligt i atmosfæren, bruges som beskyttende atmosfære i vinflasker, så vinen ikke oxideres. Der er 76 grundstoffer tilbage, når man trækker de fem grundstoffer fra i gruppe 18, som du ikke allerede har streget. Hvilke grundstoffer har du tilbage?
Et brændstof, der skal bruges i store mængder, bør naturligvis ikke laves af grundstoffer, der har lav forekomst på jorden, og er alt for dyrebare. Det er ikke bæredygtigt. Det dyreste ikke-syntetiske grundstof er rhodium, der koster omkring 1 million kr./kg. Herefter kommer cæsium og iridium. Vidste du, at grundstoffet iridium er et vidnesbyrd om dinosaurens uddøen? Ædelmetallet er meget sjældent i jordskorpen, men findes mere hyppigt i meteoritter. Det kobles til, at meteornedslag menes at være skyld i dinosaurernes uddøen . Også palladium, guld og sølv er for dyre. Platin er også for dyr og er på listen kritiske råstoffer, sammen med rubidium, osmium, ruthenium, tellur, og rhenium.
Slet de dyreste og sjældne grundstoffer, i alt 12 grundstoffer nævnt ovenfor fra listen. Det bringer os ned på 64 grundstoffer. Hvilke grundstoffer har du tilbage på listen?
Giftighed er en væsentlig faktor, der også skal tages med i overvejelserne, når man laver et stof, der skal brændes af i en motor. Derfor må vi igen luge ud i det periodiske system. Tungmetaller kan defineres som metaller, der har en densitet over 7 g/cm3. Nogle tungmetaller som bly, kviksølv og cadmium er giftige, og de medfører ved ophobning i mennesker og dyr, alvorlige sygdomme. Bly, brugte man i oldtiden til at lave vandrør af, men det stoppede, da man opdagede, at bly er giftigt. Også andre grundstoffer end tungmetaller, kan være giftige ved indtagelse i store mængder, bl.a. mangan, beryllium, antimon og aluminium. Aluminium er meget anvendt og uskadeligt i små koncentrationer, men er giftigt i høje koncentrationer. Grundstoffet arsen forekommer mange steder i verden i høje koncentrationer i visse fødevarer fx ris, og grundstoffet er i sig selv giftigt. Den meget giftige arsenforbindelse arsenik, har både være misbrugt til mord, og brugt i god tro til behandling af bl.a. syfilis. Også grundstoffet polonium omtalt tidligere (og allerede streget fra listen) er ekstremt giftigt. Tungmetallerne thallium og chrom, kan føjes til listen over stoffer er der giftige, hvis de indtages.
Mens vi er i gang, kan vi lige så godt skille os af med de fire halogener (grundstofferne i 7. hovedgruppe, eller gruppe 17), vi ikke allerede har smidt ud. Halogen betyder saltdanner, du kender grundstoffet chlor, der indgår i køkkensalt. Men halogener er giftige, når de ikke indgår i salte, primært pga deres meget høje reaktivitet. Bl.a. blev chlorgas brugt som kemisk krigsvåben i 1. verdenskrig. Streg ovenstående 14 grundstoffer fra listen, så vi kommer ned på 50. Hvilke grundstoffer har du nu tilbage?
Da brændstoffet skal være nemt at påfylde, opbevare og føre ind i motoren, skal det være enten en væske eller gas. Derfor skal du strege alle metallerne fra din liste, kviksølv, det eneste flydende metal ved stuetemperatur, har du allerede streget. Pas på ikke at strege halvmetallene (bor, silicium, germanium, arsen, antimon, tellur, astat), som du finder på skillelinjen mellem metaller og ikke-metaller, med mindre de allerede er streget fra listen. Da metallerne udgør langt de fleste af grundstofferne, har vi nu indsnævret listen. Tilbage på din liste bør være 10 grundstoffer der har potentiale til at indgå i grønne og bæredygtige brændstoffer.
Halvmetaller er grundstoffer, der både har metalliske og ikke metalliske egenskaber. Grundstoffet bor er et halvmetal, der bl.a. anvendes i kemiske forbindelser, fx som tilsætningsstof i glas, eller i store molekyler, såkaldte polymerer. Måske du selv har anvendt borax, hvis du har lavet slim ud fra bl.a. kontaktlinsevæske. Her gør borforbindelserne i væsken, slimen elastisk og holder slimen sammen. Bor indgår i kemiske forbindelser med højt energiindhold, og det bruges da også i raketbrændstof. Men bor er vanskeligt og dyrt at udvinde industrielt. Det går ikke, når vi skal bruge store mængder af det som brændstof. De andre halvmetaller, der er tungere end bor slettes også (du har allerede slettet nogle af dem). Tilbage står du med 7 grundstoffer, hvilke?
Svovl brænder fint, men afbrænding af svovl vil føre til dannelse af bl.a. svovldioxid, der biddrager til luftforurening. Phosphor er et hyppigt forekommende grundstof i jordskorpen, og indgår fx i tændstikker, men nogle former af phosphor vil gerne begynde at brænde af sig selv. Nitrogen er hyppigt forekommende i atmosfæren, men også en populær ingrediens i sprængstoffer, og vi vil ikke have brændstoffer, der eksploderer. Selen er godt i bittesmå mængder, og er et såkaldt mikronæringsstof, men giftigt i store mængder, så selen udelades også.
Der er nu tre grundstoffer tilbage på listen. Hvilke grundstoffer vil du så foreslå til anvendelse i bæredygtige brændstoffer?
Sammenlign med dit eget bud på (i starten af opgaven) , hvilke grundstoffer vi bør udelade at anvende i grønne brændstoffer.
Se mere
Som opgave 2 viste, har grundstofferne helt forskellige egenskaber, forekomster og anvendelsesmuligheder. I kemi i gymnasiet kommer du mest til at arbejde med de 20 første grundstoffer, selvom du også kommer til at møde andre som fx jern og sølv, som tilhører dem vi kalder overgangsmetaller. I 2015 kom de sidste grundstoffer (113-118) til i det periodiske system, hvor de fik navne og den internationale kemiske organisation IUPAC, anerkendte disse syntetiske grundstoffernes opdagelse.
der kun er fremstillet 4 atomer af det syntetiske grundstof organesson med atomnummer 118?
Ligesom du har lært at kende alfabetet, da du var lille, skal du kende navnet og atomsymbolet på nogle af de grundstoffer, du omgiver dig med, og som du møder igen og igen. Man kan sige, at grundstofferne er universets alfabet. Vi starter med de første 20 grundstoffer. Dem skal du kende til. Eksempelvis er det helt katastrofalt at bytte om på natrium (Na) og nitrogen (N), hvor det ene er et reaktivt metal, som indgår i køkkensalt, mens det andet er en del af den luft, du indånder. Det er vidt forskellige grundstoffer med vidt forskellige egenskaber.
Se mere
Hvis du allerede nu er blevet lidt optaget af grundstofferne og vil vide mere om grundstoffernes forunderlige verden, kan du lytte til podcasts om alle grundstofferne her (ca. 15 min.), eller her (ca. 35 min.).
Ja, du er dannet af stjernestøv og for at forstå, hvordan det kan give mening, skal vi se på, hvordan de naturligt forekommende grundstoffer dannes. De letteste grundstoffer med atomnummer 1-4, nemlig hydrogen, helium, lithium og beryllium, menes ifølge Big Bang teorien, at være dannet på tre minutter i forbindelse med universets dannelse for mere end 13 mia. år siden. Der blev dog kun dannet meget lidt lithium. Det betyder, at der er i dag er meget hydrogen og helium, men kun lidt lithium. Og det er rigtigt ærgerligt, da lithium indgår i mange typer af batterier i dag.
Ud over lithium blev der dannet meget små mængder beryllium og bor. Alle de andre grundstoffer (dog undtagen de syntetiske grundstoffer) er dannet efter Big Bang i stjernernes indre ved fusion (sammensmeltning af atomkerner, hvor to eller flere atomkerner forenes til en tungere kerne) og ved supernovaer (kraftig eksplosion fra en døende stjerne).
Det afhænger af stjernens masse, hvilke grundstoffer, der kan skabes i den enkelte stjerne. I afsnit 6 dykker vi mere ned i grundstoffernes forekomst.
Grundstofferne, der opbygger alt materiale og alt liv, er dannet af stjernestøv, og derfor er du dannet af stjernestøv.

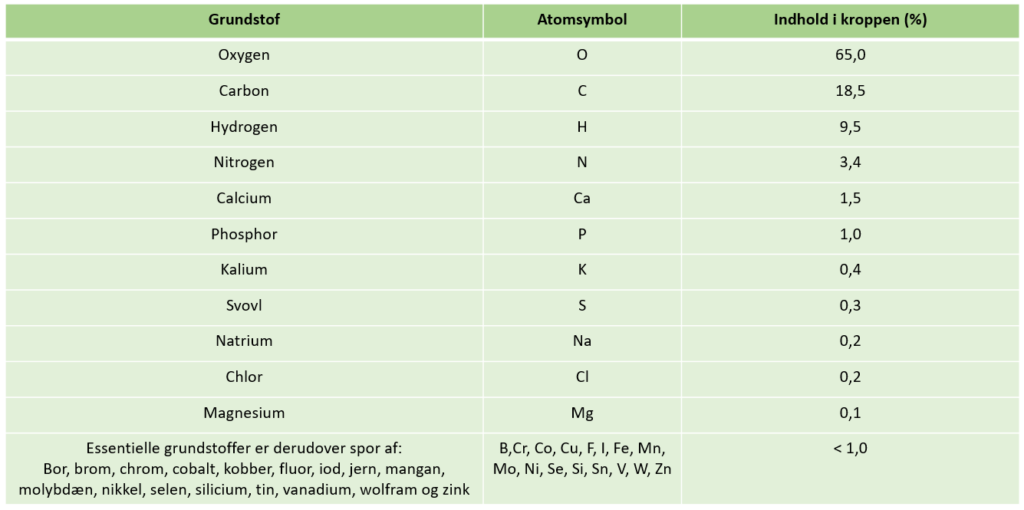
Grundstoffer er som nævnt ovenfor, stoffer, der kun består af atomer med samme atomnummer, som fx guld vist på figur 2. Kemiske forbindelser er derimod sammensat af atomer fra mindst to forskellige grundstoffer, fx er vand (H2O) en kemisk forbindelse. I figur 4 er vist, hvilke grundstoffer, der er udgangspunkt for opbygningen af de kemiske forbindelser i kroppen. Her forekommer grundstofferne altså ikke som frie grundstoffer, men er byggesten for kemiske forbindelser, der enten er molekyler eller ionforbindelser. Både grundstoffer og kemiske forbindelser er rene stoffer, mens andre stoffer er blandinger. Havvand og blod er forskellige eksempler på blandinger. Blandinger består nemlig af flere forskellige grundstoffer og eller flere forskellige kemiske forbindelser. Her finder ud en oversigt over disse faglige begreber. Essentielle grundstoffer er grundstoffer, der er livsvigtige for mennesker. Som angivet i figur 4, kan omkring 28 grundstoffer angives for at være essentielle. Nogle af de essentielle grundstoffer er kun nødvendige i ganske små mængder, som angivet i figur 4.
Se mere
Du er ikke en robot, men…
du indeholder metal, og modsat robotten kan du tænke selvstændigt. Der findes mange flere metaller end ikke-metaller og halvmetaller blandt grundstofferne, så det er ikke så underligt, at de også spiller en rolle i levende organismer.
Din krop indeholder mange forskellige metaller, og de fleste af dem er helt essentielle for, at du kan leve og fungere. Men det skal være i den rigtige koncentration, for har du for lidt eller for meget af et metal i kroppen, kan det være farligt for dig. Heldigvis er kroppen utrolig god til at regulere koncentrationen.

De gode
Tag nu fx metallet natrium. Det reagerer meget voldsomt med vand (Se denne video). Men når grundstoffet findes på ionform (Na+) og altså har afgivet sin elektron i yderste skal, er det ganske uskadeligt, og det indgår jo som en bestanddel af køkkensalt (NaCl). Natrium-ionen er sammen med kalium-ionen (K+), med til at sørge for, at der sendes nervesignaler rundt om i din krop, så bl.a. hjertet slår, og du kan tænke og føle. Den skadelige effekt af for meget natrium i kroppen er ret velkendt og derfor bør du ikke bruge for meget salt, da det fx kan give forhøjet blodtryk. Ligesom natrium- og kalium-ionen, findes der også meget af calcium-ionen (Ca2+) i din krop. Du kan læse mere om calcium og kalk her.
Jern, spiller også en vigtig rolle i kroppen. Jern indgår på ionform som Fe2+ i både hæmoglobin og myoglobin i blodet, hvor det medvirker til at binde ilt (på kemisprog dioxygen, O2), og farve blodet rødt.
De onde
Alle metallerne i din krop findes på ionform og ikke som rene metalatomer. Nogle skal du have mere af end andre, og så er der dem, du slet ikke skal have! De tilhører tungmetallerne. Det drejer sig fx om kviksølv (Hg), bly (Pb) og cadmium (Cd). De er nemlig giftige i helt små koncentrationer. De findes alle som ioner med ladningen +2: Hg2+, Pb2+ og Cd2+. Det betyder, at de kan sætte sig fast i bl.a. proteiner i stedet for andre ioner, der ligner i størrelse og ladning, som fx Ca2+, Mg2+, Zn2+, det er også omtalt i afsnit 3.5 her. Disse ioner har desuden en tendens til at binde sig til større, organiske molekyler, og det gør bl.a. at de kan ophobe sig i fedtvæv fx i hjernen. Dermed har kroppen svært ved at skille sig af med dem, fordi de ikke kan vaskes ud med vandet, vi drikker. Over tid ophobes mere og mere af disse tungmetaller, og vi kan få forskellige sygdomme, som er illustreret i figur 5.
Kemi kan behandle akut tungmetalforgiftning
Den kemiske forbindelse, EDTA (med det kemiske navn: ethylen-diamin-tetra-eddikesyre), bruges i mange sammenhænge, til at binde positive ioner med ladningen +2, som vist i reaktionsskema 1.
1) EDTA4- + Pb2+ → Pb(EDTA)2-
Reaktionsskemaet viser, at EDTA4- binder til bly-ionen, Pb2+, i blodet ved blyforgiftning. Produktet er den kemiske forbindelse bestående af bly og EDTA, der kan udskilles med urinen. EDTA4- kan dog også binde til andre metal-ioner.
EDTA bruges i fødevareindustrien, i tekstilindustrien og i rengøringsmidler m.m. Derudover bruges det som middel mod akut forgiftning med tungmetaller, hvor det sprøjtes ind i blodet hos en patient. EDTA er negativt ladet og er derfor tiltrukket af de positive tungmetal-ioner. De to ioner binder stærkt til hinanden, og som resultat af EDTA behandlingen, er der ikke længere er frie bly-ioner i blodet. Produktet af reaktionen vist i reaktionsskema 1. udskilles gennem urinen.
Du har nu fået et indblik i nogle metallers rolle i levende organismer. Men nu skal det handle om hvordan de enkelte atomer er opbygget.
Se mere
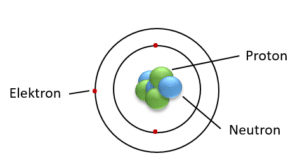
Protoner og neutroner kaldes tilsammen for nukleoner, da de sammen udgør atomets kerne (engelsk nucleus). Protoner er positive, mens neutroner er neutrale. Elektroner derimod er ikke nukleoner, da de befinder sig rundt om atomkernen, som vist i figur 6. De er også meget lettere end nukleonerne. Antallet af protoner og elektroner er ens, da atomet er elektrisk neutralt.
Atomkernen holdes bl.a. sammen af den stærke kernekraft, som du måske har hørt om i fysik. Protoner vil normalt frastøde hinanden pga. deres positive ladning. Men det sker ikke, da både protoner og neutroner er bundet sammen af den stærke kernekraft. Den binder protonerne og neutronerne så stærkt sammen, at den ’overvinder’ den elektromagnetiske kraft, der eller ville frastøde protonerne fra hinanden.
Dertil kommer, at antallet af protoner og neutroner er ca. lige stort, så protonernes elektromagnetiske frastødning mindskes.
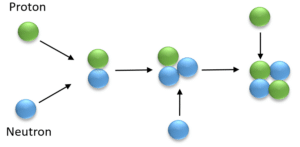
Med viden om protoner og neutroner kan vi begynde at forstå, hvordan de første grundstoffer er blevet dannet i Big bang, se figur 7. Nu kan vi også opskrive nogle af de kerneprocesser, der har dannet grundstofferne. Bemærk at det ikke er kemiske reaktioner, som jo kun involverer elektronerne, men derimod fysiske atomkerneprocesser som kun er sket i Big bang, eller sker i stjerner og større objekter, og som vi ikke kan lave i et kemilaboratorium. Det er såkaldte fusionsprocesser, da to atomkerner fusionerer. Som vist i figur 7, fusionerer en proton og en neutron og dannes en deuterium kerne (der er en isotop af hydrogen). Tilføres en neutron mere, dannes en tritium kerne (også en hydrogenisotop), og tilføres en proton mere, er heliumkernen dannet. Isotoper forklares nærmere nedenfor. Senere, begyndte elektroner at gå i kredsløb om atomkernerne, og de meste simple af atomerne blev dannet.
Nedenfor undersøger vi forskellige atomer, og lærer at opskrive dem korrekt.
Figur 8.a viser et atom med tre protoner og tre neutroner i kernen, samt tre elektroner omkring. Da det er antallet af protoner (atomnummeret), der afgør, hvilket atom det er, ser vi i det periodiske system, at atomnummer tre er lithium. Antallet af neutroner kan derimod variere i atomer af samme grundstof. Atomer med samme antal protoner, men forskellige antal neutroner, kaldes isotoper. Lithium forekommer naturligt i to forskellige stabile isotoper. I den ene isotop er der tre neutroner i kernen, mens der i den anden isotop er fire. Antallet af protoner naturligvis er det samme. Da det er protoner og neutroner, der tilsammen bidrager til atomets masse (elektronerne er forsvindende små i den sammenhæng), kalder vi summen af disse to tal for massetallet. Det kan vi generelt opskrive som i figur 8 b.
a.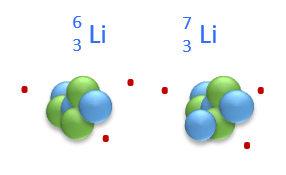
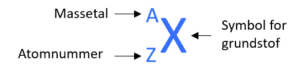
Massetallet svarer altså til antal nukleoner i kernen, mens atomnummeret svarer til antal protoner. Ved at trække de to tal fra hinanden, fås antallet af neutroner.
A-Z = N – hvor A er massetal, Z er atomnummer og N er antallet af protoner.
Du finder metallet aluminium overalt i din hverdag. Det er et meget let metal med en række anvendelser i sodavandsdåser, konservesdåser, og ’sølvpapir’ der bedre beskrives som alufolie. Aluminium indgår også i biler, cykler og fly. Grundstoffet findes dog ikke frit i naturen, men udgør ca. 8% af jordskorpen, hvor størstedelen forekommer i en kemiske forbindelse i bjergarten bauxit. H. C. Ørsted isolerede som den første grundstoffet aluminium.
Et aluminiumsatom kan opskrives 27 / 13 AI
Se mere
Nu skal du træne grundstofforståelse ved at bestemme antallet af protoner, neutroner, elektroner og navnet på grundstoffet i følgende:
23 / 11 Na
59 / 28 Ni
118 / 50 ?
120 / 50 ?
59 / ? Co
60 / ? Co
Se mere
Atomer kommer altså i forskellige ’udgaver’, da de har forskelligt antal neutroner i kernen.
Tre carbon isotoper forekommer naturligt, carbon 12, 13 og 14. Carbon 12 og 13 er stabile. At isotopen er stabil betyder at den ikke er radioaktiv og altså at den ikke henfalder. Nogle atomkerner er nemlig ustabile, og vil på et tidspunkt af sig selv henfalde til andre atomkerner, under udsendelse af radioaktiv stråling. Det gælder carbon-13 og carbon-14 isotoperne. Du har måske hørt om carbon-14 metoden tidligere. Carbon 14 er ustabil og radioaktiv og har en halveringstid på 5730 år.
Carbon 14-metoden er en hyppigt anvendt dateringsmetode til aldersbestemmelse. Her udnytter man, at alle levende organismer optager carbon-14, men at optaget stopper når organismen dør. Herefter henfalder carbon-14 og der bliver mindre af det, så ved at måle indholdet af carbon-14 isotopen, der er tilbage i prøvematerialet, kan alderen af prøven beregnes, ud fra den tid det tager for carbon-14 isotopen at henfalde.
Se mere
Alle isotoper af et grundstof har samme kemiske egenskaber (stort set) og derfor er isotoper måske lidt kedelige, kemisk set. Det er nemlig antallet at protoner, der afgør hvilket grundstof der er tale om, og antal elektroner i de yderste elektronskaller, der afgør de kemiske egenskaber.
I figur 9 er samlet en række data om nukleoner og elektronen. Læg mærke til at protonens og neutronens masse er næsten ens, og mange gange større (ca. 2000 gange) end elektronens masse. Det betyder, at hele atomets masse er centreret i atomkernen.
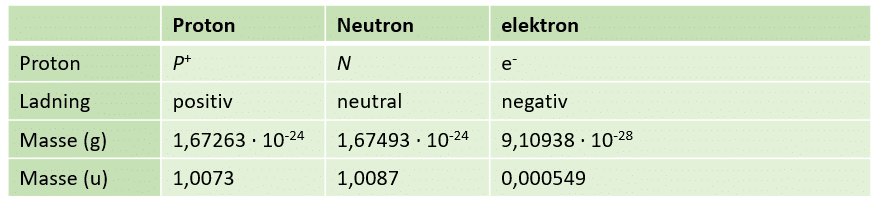
Figur 9. Tabellen viser udvalgte data om protoner, neutroner og elektroner.
Partiklernes (protonen, neutronen og elektronen) masse måles i enheden units angivet u. Unit er en meget lille enhed: 1 u svarer til 1,6605*10-24 g. Unit er defineret som 1/12 af massen af Carbon-12.
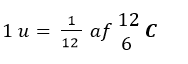
Overvej, før du læser videre, hvorfor mon massen for carbon i det periodiske system er 12,01 u og ikke 12,00 u
Se mere
Hvis et grundstof kun havde en isotop, ville det være nemt at finde atommassen. Men fordi isotoper af et grundstof har forskelligt antal neutroner, har isotoperne også forskellig masse. Et grundstofs gennemsnitlige masse afhænger af forekomsten af de enkelte isotoper.
Et grundstofs atommasse defineres som gennemsnitsmassen af atomerne i grundstoffets naturlige isotopforekomst.
Vi ser igen på de tre naturligt forekommende carbon isotoper, se figur 10.
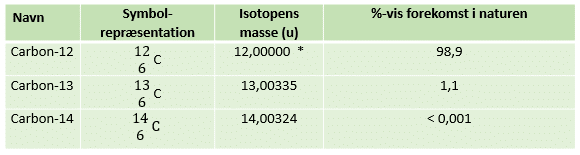
For at bestemme carbons atommasse, som er opgivet i det periodiske system, laver vi følgende beregning, hvor vi ganger forekomsten af isotopen med massen af isotopen, det gør vi for hver isotop og lægger de enkelte isotopers biddrag sammen:
(98,9 /100) * 12,00000 u + (1,1 /100) * 13,00335 u + (0,001/100) * 14,00324 u = 12,011u
Indholdet af carbon-14 isotopen er så forsvindende lille, at den faktisk er uden betydning i forhold til den gennemsnitlige masse, men er alligevel taget med. Den gennemsnitlige masse af et carbonatom er altså 12,011u.
Lægger man alle atommasserne angivet i unit i figur 9 sammen, fås nogle lidt andre værdier end dem som er opgiver i figur 10. Forklaringen er den, at masserne i figur 9 er bestemt ved måling af de frie elementarpartikler, og atommasserne i figur 10 er bestemt ved måling af at hele atomet. Det kan vi forklare således: I fysik har du måske hørt om massedefekten. Kort fortalt kan man sige, at for alle atomkerner gælder det, at summen af masserne af alle atomkernens enkelte protoner og neutroner, er større en massen af den samlede bundne atomkerne. Dette massetab kaldes også massedefekten.
Derfor beregner man ikke atomets nøjagtige masse, i stedet for måler man atommassen med et såkaldt massespektrometer.
For at bestemme carbons atommasse, som er opgivet i det periodiske system, laver vi følgende beregning, hvor vi ganger forekomsten af isotopen med massen af isotopen, det gør vi for hver isotop og lægger de enkelte isotopers biddrag sammen:
(98,9 /100) * 12,00000 u + (1,1 /100) * 13,00335 u + (0,001/100) * 14,00324 u = 12,011u
Indholdet af carbon-14 isotopen er så forsvindende lille, at den faktisk er uden betydning i forhold til den gennemsnitlige masse, men er alligevel taget med. Den gennemsnitlige masse af et carbonatom er altså 12,011u.
Lægger man alle atommasserne angivet i unit i figur 9 sammen, fås nogle lidt andre værdier end dem som er opgiver i figur 10. Forklaringen er den, at masserne i figur 9 er bestemt ved måling af de frie elementarpartikler, og atommasserne i figur 10 er bestemt ved måling af at hele atomet. Det kan vi forklare således: I fysik har du måske hørt om massedefekten. Kort fortalt kan man sige, at for alle atomkerner gælder det, at summen af masserne af alle atomkernens enkelte protoner og neutroner, er større en massen af den samlede bundne atomkerne. Dette massetab kaldes også massedefekten.
Derfor beregner man ikke atomets nøjagtige masse, i stedet for måler man atommassen med et såkaldt massespektrometer.
Se mere
I faktaboksen nedenfor kan du læse lidt om, hvad et massespektrometer er.
Et massespektrometer (MS-apparat) bruges i kemisk forskning til at bestemme massen af atomer og molekyler. Her er fokus på, hvordan man analyserer molekyler, men princippet er det samme for atomer.
Forestil dig, at du har lavet et forsøg i laboratoriet, men du er usikker på, hvilket stof du har fået dannet. Er det stof A eller stof B? Der er vigtigt at vide, også fordi du kun må fortsætte med at lave det næste forsøg, hvis du har stof A og ikke stof B. Du ved, at stof A er har en mindre molarmasse end stof B. For at finde ud af, om du kan gå videre med dit forsøg, kan du vha. et MS-apparat finde ud af, om molarmassen af det stof, du har i din koniske kolbe, svarer til stof A eller stof B.
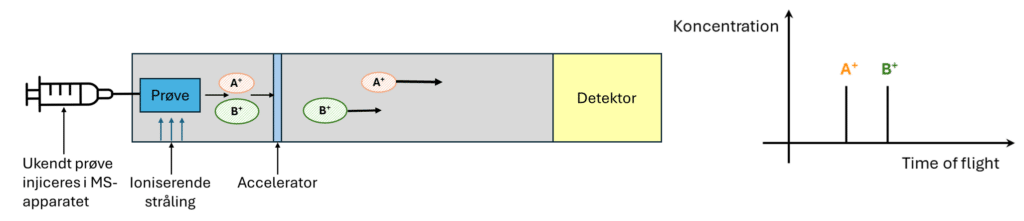
Du tager en prøve fra din koniske kolbe, som du sprøjter ind i MS-apparatet, se figur 11. Ved at bestråle prøven med ioniserende stråling, kan dit stof miste en elektron og dermed fx blive til en positiv ion. Ionerne sendes herefter gennem en accelerator, så ionerne får fart på. Jo mindre masse en ion har, jo højere fart får den. Det svarer lidt til, hvis du skal kaste to håndbolde til din medspiller, hvor den ene er en almindelig håndbold og den anden har samme størrelse, men vejer meget mere. Hvis du kaster begge med samme kraft, får den almindelige håndbold mere fart på end den anden.
Detektoren, der registrerer tiden fra ionerne bliver accelereret til de rammer detektoren (time of flight), omsætter disse data til en graf, som du kan tolke. Hvis begge stoffer er til stede i din prøve, vil grafen ligne den i figur 11, mens hvis der kun skal være A til stede i prøven, er der kun en top i grafen ved stof A.
Marianne Glasius, lektor på Institut for Kemi på Aarhus Universitet, bruger massespektrometre i sin forskning, hvor hun bl.a. studerer partikler i atmosfæren. Hun har været med til at analysere partikler, der udledes, når der er tændt op i brændeovne rundt om i Danmark. Bl.a. på baggrund af hendes og kollegers resultater, strammede man lovgivningen omkring brændeovne, så udledningen sundhedsskadelige partikler reduceredes.

Se mere
4. Atommodeller og videnskabsteori
Om lidt ser på, hvordan man gennem tiden har opstillet forskellige atommodeller. Som det fremgår, står forskerne på skuldrene af hinanden, og videreudvikler hinandens teorier. Og sådan er det inden for alle videnskaber. I naturvidenskab er det særlige, at man kan afprøve teorierne ved at opstille en hypotese (forventning) og dernæst undersøge om data fra både eksperimenter og beregninger passer, og så enten forkaste eller acceptere teorien. Det omtales ofte i gymnasiet som den hypotetisk deduktive metode, som omtalt i klippet her. Den hypotetisk deduktive metode er central i formidlingen af naturvidenskab, men nye opdagelser i naturvidenskab udspringer oftest fra den induktive metode. Den induktive metode går ud på, at man på baggrund at data fra forsøg og observationer, opstiller en teori eller udleder nogle generelle principper. Det omtales i klippet her.
Vi starter med Thomsons model. Den britiske fysiker Joseph John Thomson opdagede elektronen i 1897. Senere opstillede han en atommodel, vi i dag ofte omtaler som rosinbollemodellen, hvor de negative elektroner bevæger sig rundt i en positiv masse se figur 12.

Ernest Rutherford fandt på baggrund af forsøg og observationer, i 1911 ud af, at det meste af atomets masse var samlet i en lille, positiv kerne, som elektronerne så bevægede sig rundt om. Han fandt også ud af, at atomkernen udgør det meste af atomets vægt. Men han havde ingen bud på, hvordan elektronerne var fordelt i atomet, andet end at de cirklede om den positive kerne i baner, der mindende om planeter, der cirkler om solen, som illustreret i figur 13. Rutherfords atommodel afspejlede nogle af de observationer og målinger man kunne lave, men den forklarede ikke alle data man havde fra eksperimenter (fx hydrogens linjespektrum).
Niels Bohr kom op med en bedre model, baseret på Rutherfords model og Plancks ide om kvantificering af energien (Max Planck var fysiker og grundlægger af kvantemekanikken), i 1913. Denne atommodel er simpel og intuitiv model, kunne forklare nogle af de data (igen fx hydrogens linjespektrum), som den tidligere model ikke kunne forklare.
Niels Bohrs skalmodel, se figur 14, er den atommodel du skal kende til og forstå. Det nye i punkt i forhold til Rutherfords model er, at elektronerne bevæger sig i helt specifikke baner, og at hver bane er karakteriseret ved et bestemt energiniveau. Man siger, at jo længere ind mod atomkernen, jo lavere energiniveau har elektronskallen, og modsat, jo længere væk fra atomkernen, jo højere energiniveau har elektronskallen.
Bohr forklarede også, at elektroner kan springe mellem banerne ved at optage eller udsende lys. På den måde kunne hans teori forklare, hvorfor grundstofferne udsender lys med ganske bestemte energiniveauer og farver. Og det er netop omdrejningspunktet i elevforsøg omtalt nedenfor.
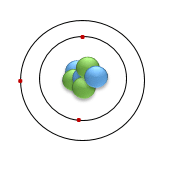
Undersøg figur 14, og find ud af hvilket grundstof det er en model for.
Opskriv grundstofsymbol, massetal og atomnummer, som vist i figur 8.
Se mere
På baggrund af Niels Bohrs atommodel og andres eksperimenter, udviklede Erwin Schrödinger m.fl. i 1925, en abstrakt kvantemekanisk tredimensionel atommodel, som er angivet i figur 14. De klassiske fysiske love (klassisk mekanik) kan ikke bruges for atomer, nukleoner og elektroner, der skal i stedet for anvendes såkaldte ’kvantemekaniske love’, der er inddraget i den kvantemekaniske atommodel. Her er atomkernen og elektronskallerne i stedet for, beskrevet som tredimensionale sandsynlighedsfordelinger for, hvor elektronerne er. Disse er angivet som elektronskyer. En elektronsky skal forstås som det område, hvor elektronen mest sandsynligt befinder sig. Dette område, hvor elektronen mest sandsynligt befinder sig, er mange gange større end atomets kerne. Sådan er det dog sjældent illustreret, heller ikke i figur 14, fordi så ville vi slet ikke kunne se atomkernen.
Hver skal i Bohrs atommodel gives numre 1,2,3,4 og frem (indimellem med bogstaver: k,l,m,n og frem). I den kvantemekaniske model består hver elektronskal af en eller flere ’underskaller’. Det område af ’underskallen’ hvor elektronen mest sandsynligt opholder sig, kaldes en orbital. Orbitalerne angives med bogstaverne s, p, d eller f orbitaler. Der er dog lidt mere til forklaringen, den kan du få på kemi A.
Vi vender kort tilbage til det her med s, p, d og f orbitaler, når vi skal se på opbygningen af grundstoffernes periodiske system.
Analyser de fire atommodeller vist i figurerne 12-14.
Se mere
Niels Bohr foreslog som omtalt ovenfor, at elektroner kan springe mellem banerne ved at optage eller udsende lys. Han mente, at farven på lyset svarer til energiforskellen mellem to baner. Det omtales yderligere i øvelsen flammefarver nedenfor, og illustreret i figur 15. Netop Bohrs atommodel kunne altså forklare, hvorfor grundstofferne udsender lys med ganske bestemte farver, noget der ikke kunne forklares i de tidligere atommodeller. For alle grundstoffer har et unikt ’farve-fingeraftryk’, som kaldes spektrallinjer, du måske har hørt om i fysik.

Ved et test for flammefarve, kan man detektere tilstedeværelsen af et givent metal, ved at brænde et salt af, hvori metal-ionen indgår. Derved ses metallets karakteristiske flammefarvet. Forsøget omtalt nedenfor handler om netop det.
Her inddrages Niels Bohrs atommodel. Det ligger tilgængeligt under fanen eksperimentelt arbejde under Grundstoffer og bæredygtighed
Som afslutning på flammefarver bør du se dette lille filmklip (3,5 minutter) fra Testoteket (Astra) om netop flammefarver .
Vi skal nu til noget helt centralt i kemien, som du kommer til at vende tilbage til igen og igen – nemlig grundstoffernes periodiske system.
5. Hvad er systemet i grundstoffernes periodiske system?
Ligesom andre store opdagelser, var systematiseringen af grundstoffernes periodiske system for mere end 150 år siden (1869) ikke en pludselig opstået ide. Den byggede både på flere kemikeres arbejde, og også på andre videnskabers systematik. Det er oftest Dmitrij Mendelejev, der får æren for at opstille grundstofferne i det periodiske system, da hans system var det eneste, der omfattede alle de dengang kendte grundstoffer, selvom nogle var forkert placeret. Han forudså faktisk også, at det periodiske system måtte indeholde grundstoffer, der bare ikke var opdaget endnu.
Se mere
Kig på det periodiske system, se figur 15.
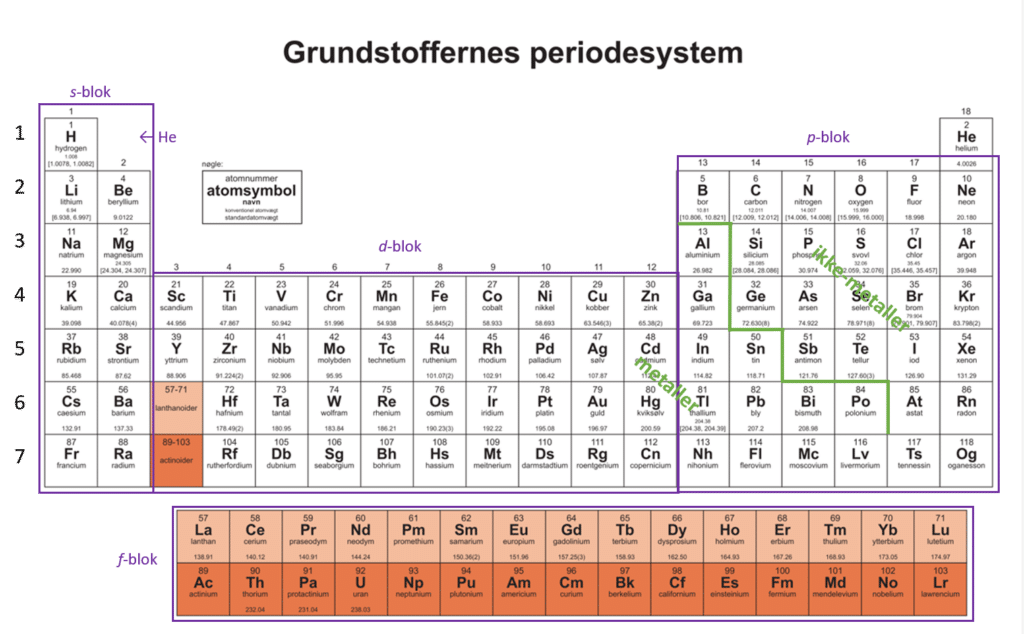
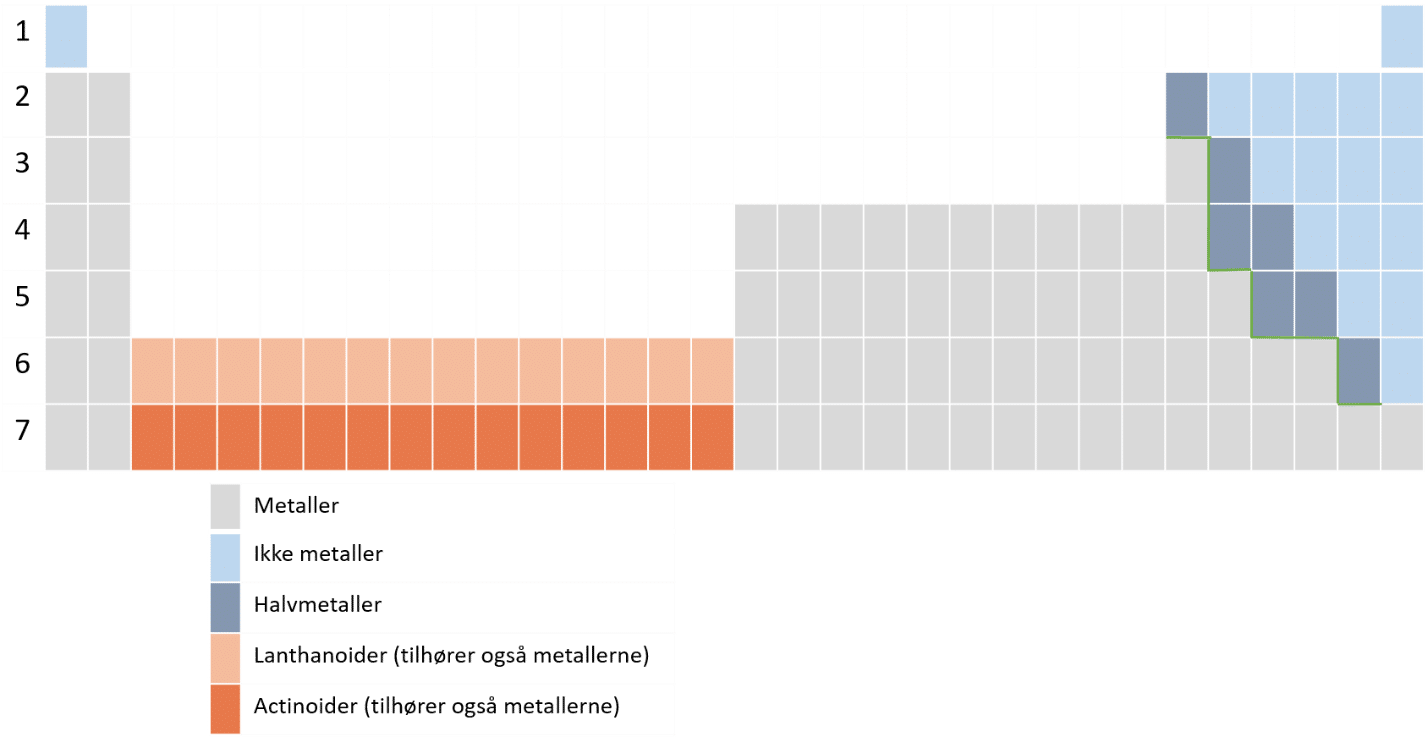
Figur 16 viser en illustration af det periodiske system, som et hus med 2 tårne (gruppe 1-2 og gr. 13-18, der omtales som hovedgrupper). De to tårne er indbyrdes forbundne af en mellembygning, der udgøres af hvad vi kalder overgangsmetaller (undergruppemetaller eller d-blokken) og indbefatter gruppe 3-12. Huset har også en trappe og den kender du måske allerede, da den markerer skillelinjen mellem metaller (til venstre for trappen) og ikke metaller (til højre for trappen). Trappen er vist med grønt. Grundstofferne omkring trappen er halvmetaller. Endelig er der kælderen, grundstoffer der ligger her, er placeret anderledes, lidt ligesom Bornholm indimellem placeres på et landkort et andet sted, end hvor det geografisk ligger, for at det kan rummes på kortet.
I figur 22 er vist en udgave af det periodiske system, hvor actinoider og lanthanoider (kælderen på figur 16), er sat ind hvor det hører til.
I det periodiske system, er det angivet, om grundstoffet er et metal, et ikke-metal, eller et halvmetal.

Metaller udgør langt den største del af grundstofferne, og du finder dem mod venstre og nedad i det periodiske system. Metaller har nogle fælles kemiske og fysiske egenskaber. Fx er de gode til at lede varme og elektrisk strøm. Andre ligheder er, at de atomer, der opbygger metallet har få elektroner i yderste skal, og metalatomer vil derfor gerne afgive elektroner Metaller har lav elektronegativitet. Læs mere om elektronegativitet her. Metaller danner altid positive ioner, ved at afgive elektroner.
Ikke-metaller har også nogle fælles kemiske og fysiske egenskaber. Fx er de dårlige til at lede varme og til at lede elektrisk strøm. Ikke-metaller har højere elektronegativitet, og danner typisk negative ioner ved at optage elektroner.
Halvmetaller har, som du måske har gættet, egenskaber, der ligger mellem metaller og ikke metaller. De er i det periodiske system placeret omkring metaltrappen og adskiller metaller og ikke metaller.
I grundstoffernes periodiske system er der ofte desuden angivet hvilken tilstandsform, det enkelte grundstof er på ved stuetemperatur og normalt tryk. Fast stof er angivet med et s, der står for fast stof (engelsk: solid). Kviksølv (Hg) er et af de få grundstoffer, der er flydende ved stuetemperatur. Tilstandsformen flydende, er angivet med et l for væske (engelsk: liquid). Nogle grundstoffer er gasser, hvilket angives med g.
Hvad gælder typisk for metaller, ikke-metaller og halvmetallers tilstandsformer? Brug evt. linket her.
Kom med nogle eksempler og nogle generaliseringer.
Se mere
På kemi C er det primært hovedgrupperne, der er i fokus. Men overgangsmetallerne samt lanthanoider og actinoider er vigtige i kemisk forskning, og i den grønne omstilling. Dem møder du lidt senere i temaet, og du kan også møde dem på kemi B og A.
Går du vandret i det periodiske system, hen gennem en periode, stiger atomnummeret. Der kommer både en proton og en (eller flere) neutron(er) mere i atomkernen, og en elektron mere udenom. Der er i alt 7 perioder i det periodiske system. Periodenummeret angiver antallet af skaller og nummeret på den yderste skal.
Grupperne med numrene 1-2 og 13-18 kaldes for hovedgrupper, som vist i figur 16. For hovedgrupperne gælder det, at antallet af elektroner i yderste skal er lig med hovedgruppens nummer (for gruppe 13-18 er det gruppenummeret minus 10, for gruppe 1 og 2 er gruppenummer og hovedgruppenummer ens). Fx kan gruppe 13 omtales som hovedgruppe 3 (13-10 = 3).
Når du går hen gennem en periode i hovedgrupperne, fyldes også en elektron mere i den yderste elektronskal. Som vist på figur 17 hører elektroner sammen i elektronpar. Ædelgasserne er grundstofferne i gruppe 18, der alle er gasser og er meget lidt reaktive. Deres elektronstruktur er vist (for nogle af ædelgasserne) i figur 18. De har alle 8 elektroner i yderste skal, undtagen Helium, der blot har to. Ædelgassernes elektronstruktur er meget stabil.
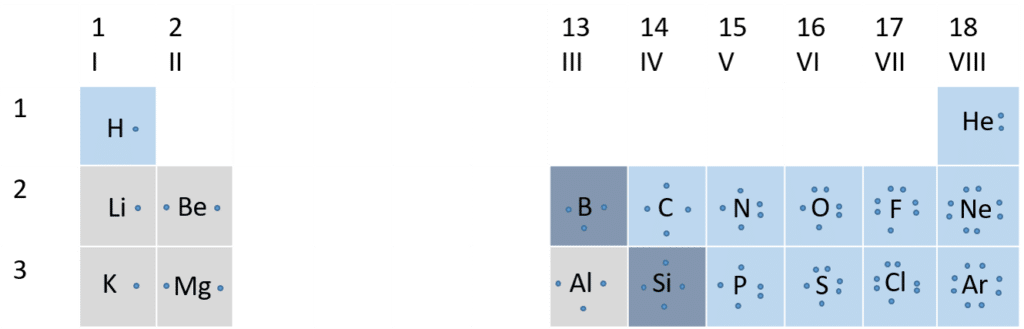
Det viser sig, at grundstoffer gerne afgiver eller optager elektroner fra deres yderste skal, så deres elektronstruktur ligner ædelgassernes med otte elektroner i yderste skal (for helium dog kun 2). Denne regel omtales som ædelgasreglen (også omtalt som oktet eller dubletreglen). Den forklarer også, at kemiske forbindelser (ioner eller molekyler) gerne vil ligne ædergasserne i deres elektronstruktur, og derfor have otte elektroner i yderste skal, ved at afgive, optager eller dele elektronerne i en kemisk binding.
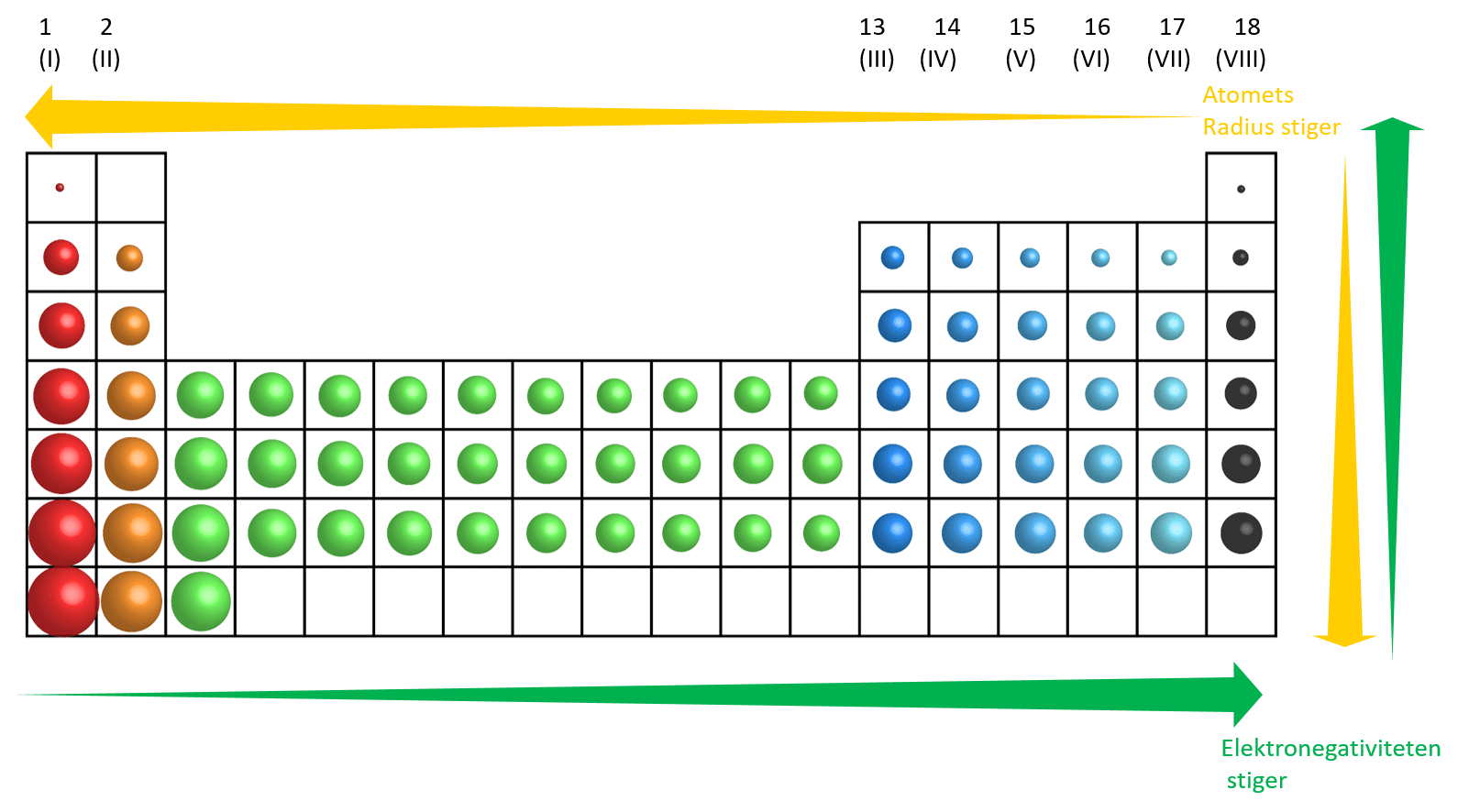
Hen gennem perioden fra venstre mod højre, mindskes atomets radius (størrelse), som vist i figur 19 for hovedgrupperne. Hvis man tænker over det giver det god mening. Hen gennem perioden kommer en proton mere i kernen og en elektron mere i skallen. Derved stiger tiltrækningen mellem den negative elektron og den positive kerne og atomets radius bliver mindre. For hovedgrupperne gælder også, at elektronegativiteten stiger hen gennem perioden, som vist i figur 19.
Der er i 8 hovedgrupper og 18 grupper som vist i figur 16 (indsæt link til afsnit 5.1) . Grundstoffer i samme gruppe har mange kemiske og fysiske ligheder, og ligheden her er langt større end ligheden mellem grundstoffer i samme periode (det gælder dog ikke for lanthanoiderne).
Går du lodret ned gennem en gruppe, bygges der hver gang en elektronskal mere på. Derfor øges atomets radius (atomets størrelse), som vist i figur 19.
Grundstoffer i en gruppe har samme antal elektroner i yderste skal. De elektroner kaldes valenselektroner. Det er valenselektronerne, der bestemmer, hvilke kemiske egenskaber et grundstof har, og derfor har grundstoffer i samme gruppe en del fælles træk. Kemien for et grundstof er altså bestemt af antallet af valenselektroner, men også af typen af valenselektroner, altså hvilken blok de kommer fra i det periodiske system som vist i figur 16. Navnene på disse blokke, er navnene på de baner (orbitaler) valenselektronerne er i, som omtalt tidligere.
Kig på figur 15 med det periodiske system.
Hvilke blokke er på spil i hovedgrupperne?
Se mere
Metallerne i gruppe 1, kaldes alkalimetaller og de hører til i hvad man kalder s -blokken. De er meget reaktive, da de kun har en elektron i yderste skal, de gerne vil afgive jfr. Ædelgasreglen (oktetreglen). Det er fint illustreret i denne video af Peter Hald, der er ekspert i showkemi og sikkerhedsleder på Institut for Kemi på Aarhus Universitet. I videoen ser du lithiums, natriums og kaliums reaktion med vand. Videoen viser både, at metaller i samme gruppe har fælles kemiske egenskaber, og også, at reaktiviteten i s-blokken stiger jo længere ned man går i gruppen (periodetallet bliver højere). Det er, fordi jo højere periodenummeret er, jo længere kommer vi fra atomkernen. Lithiums valsenselektron er holdt bedre fast til atomkernen end fx cæsiums valenselektron, fordi den er tættere på atomkernens positive ladning, og derfor er cæsium endnu mere reaktiv, da dens valenselektron sidder mere løst bundet til atomkernen. Men et fælles træk for alkalimetallerne er altså at de er reaktive.
I videoen kan man til sidst se, hvorfor alkalimetallerne kan være farlige pga. deres høje reaktivitet. Et stort stykke natrium puttes i vand, og der sker en eksplosion, hvor sikkerhedsglasset i stinkskabet går itu. Sikkerhedsglasset splintrer ikke men krakelerer, og derfor kom der ingen til skade ved forsøget.
Gruppe 1 er alkalimetaller
gruppe 2 er jordalkalimetaller
gruppe 3-12 omtales som overgangsmetallerne
gruppe 17 er halogener
gruppe 18 er ædelgasser
Se mere
Bare fordi et stof er vigtigt i små mængder, kan det være giftigt i større mængder? Det gælder fx metallerne cobalt og nikkel. Cobaltsalte menes at være kræftfremkaldende, men vi behøver alligevel en lille smule cobalt, fordi cobalt indgår i bl.a. B12-vitamin. Og hvem kender ikke til nikkeleksem? I større koncentrationer er nikkel farligt. Men nikkel finder vi også i mange enzymer og det er dermed et essentielt grundstof, ligesom cobalt. Læs mere om essentielle grundstoffer her.
Som vist i figur 15 og 16, er der 4 forskellige blokke i det periodiske system, s, p, d og f-blokken. Da blokkene er meget større end grupperne og perioderne, er der forskelle i kemien inden for blokkene. Men der er også nogle fælles træk. De fire blokke angiver typen af orbitaler, der rummer de energirigeste valenselektroner
Overgangsmetallerne, altså gruppe 3 til og med 12, tilhører d-blokken, mens lanthanoider og actinoider tilhører f-blokken.
Det periodiske system handler ikke bare om grundstofferne, men om hele kemien forklarer professor i kemi Jesper Bendix, Københavns Universitet, der har arbejdet med ca. 2/3 af de naturligt forekommende grundstoffer. Ham skal du møde i faktaboksen, der netop handler om overgangsmetallerne i d-blokken og Jesper Bendix’ forskning.

Jesper Bendix er på hjemmebane, når det kommer til grundstoffernes periodiske system. Han er uorganisk kemiker og professor på Kemisk Institut, Københavns Universitet. Som uorganisk kemiker, arbejder han med langt de fleste grundstoffer fra det periodiske system. Jesper siger: ’ I periodesystemet har vi den mest kompakte lærebog i kemi, man kan tænke sig’.

Overgangsmetallerne i d-blokken.
Jesper har i sin forskning arbejdet med overgangsmetallerne, som vi finder i den del af det periodiske system, der kaldes d-blokken, se figur 15.
Overgangsmetallerne danner ofte farvede forbindelser og er ofte gode katalysatorer. Overgangsmetallerne er slet ikke lige så reaktive som alkalimetallerne, men nogle er mere reaktive end andre. Mod højre bliver grundstofferne i periodesystemet mere elektronegative. Det gælder også for metallerne i d-blokken, hvor de, der står til højre i d-blokken, er mindre tilbøjelige til at afgive deres elektroner. Det betyder, at de bliver mindre reaktive (mere ædle). Mange af overgangsmetallerne er magnetiske, og mange kan danne flere forskellige ioner, der har forskellig ladning. Begge dele har noget at gøre med fordelingen af elektroner i skallerne.
Hen gennem en række i d-blokken, enten 4., 5., 6. eller 7. periode fyldes der en elektron mere i elektronskallen for hvert trin mod højre. Her sker opfyldningen af elektroner i næstyderste eller tredieyderste skal, som fyldes op med 10 elektroner (fra nr. 8-18) , som vist i figur 20. Og det er modsat i hovedgrupperne, hvor det er yderste elektronskal der fyldes.
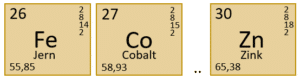
Her i d-blokken, fyldes elektronen i den del af elektronskallen, der omtales som d-orbitalerne. Ædelgasreglen gælder ikke for overgangsmetaller (d-blokken), men kun for hovedgrupperne (s og p blokken).
Blandt overgangsmetallerne finder du mange metaller, du kender.
Jern, der findes i gruppe 8, er det vigtigste af alle metallerne og det 4. hyppigst forekommende grundstof i jordskorpen. Jern er også centralt i levende organismer, og 30% af alle proteiner indeholder metal-ioner og er dermed såkaldte metalloproteiner. Alt liv er afhængigt af jern, men også kobber, mangan, og zink og i mindre grad vanadium, molybdæn, cobalt og nikkel har vigtige roller i den biologiske kemi. Liv vil derfor ophøre uden overgangsmetaller, fortæller Jesper.

Ædelmetallerne er modsat fx jern meget lidt reaktive (mere elektronegative), og de findes derfor frit i naturen. Til ædelmetallerne hører bl.a. rhodium og iridium i gruppe 9, platin og palladium i gruppe 10 og sølv og guld i gruppe 11. En kort forklaring på, hvorfor ædelmetaller er ædle, har at gøre med elektronstrukturen, da d-orbitalen er fyldt eller næsten fyldt. Den effektive kerneladning, altså atomkernens ladning, når man tager højde for, at elektronerne i de inderste skaller skærmer for kernens positive ladning, giver et endnu større bidrag til ædelmetallernes lave reaktivitet.
I gruppe 12 finder vi både zink, cadmium og kviksølv. Zink er ligesom jern et af de essentielle grundstoffer. Zink har forskellige biologiske funktioner og indgår i mange af kroppens enzymer. Cadmium og kviksølv er derimod giftige tungmetaller, der ligner zink, hvorfor de nemt optages i kroppen og indbygges i stedet for zink. Det kan føre til forskellige sygdomme bl.a. nyresvigt og kræft.
Forskning i overgangsmetaller
Hvordan er atomerne bundet sammen, når overgangsmetallerne binder til andre atomer? Og hvordan påvirkes overgangsmetallernes magnetiske egenskaber, deres farver, og deres egenskaber som katalysatorer af deres nærmeste omgivelser? Det er nogle af de spørgsmål uorganiske kemikere beskæftiger sig med.
’En af de mest fascinerende ting ved kemien, er de kreative muligheder, der er for at lave helt nye kemiske forbindelser – at have frembragt noget, som intet menneske før har haft i hånden’ siger Jesper. En del af forskningen går ud på at prøve at fremstille nye forbindelser med forbedrede egenskaber fx bedre magneter. For at forstå egenskaberne af de fremstillede forbindelser, er Jesper og hans studerende nødt til at vide nøjagtigt, hvordan de enkelte atomer er placeret i forhold til hinanden, og hvordan elektronerne er fordelt i molekylerne. For at få indsigt i atomernes indbyrdes placering anvender man ofte røntgenstråling, som ved vekselvirkning med krystaller giver nøjagtig information om placeringen at de enkelte atomer. Jesper har sammen med en gruppe forskere fået nyt udstyr, et såkaldt elektrondiffraktometer, vist på foto nedenfor.

Det betyder, at de kan undersøge krystaller, ned til størrelser på under 100 nm, altså under 0,0000001 m. Det er vist i figur 21.
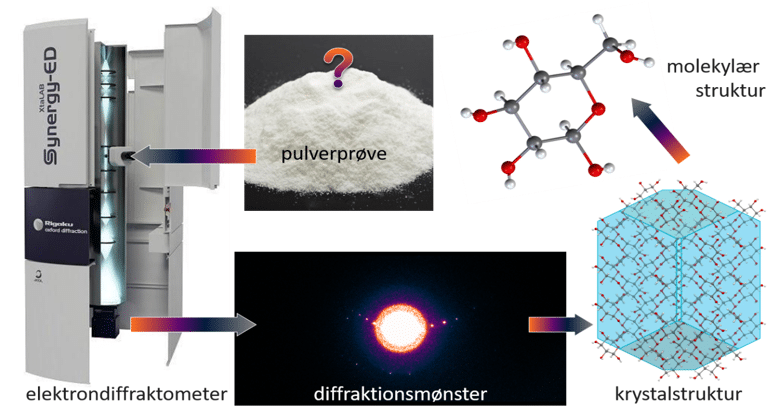
Med instrumenter som et elektrondiffraktometer er det næsten kun fantasien, der sætter grænsen for, hvilke faste stoffer man kan strukturbestemme.
Se mere
De to nederste rækker nederst i det periodiske system kaldes hhv. lanthanoider og actinoider. De er lidt særlige og fylder ikke ret meget i gymnasieundervisningen. Alligevel er de vigtige, og de er i fokus i faktaboksen ’Heltene i kælderen af det periodiske system: Om f-blokken, superhelte-metaller og Thomas Just Sørensens forskning’

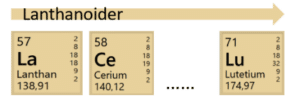
Heltene i kælderen henviser til grundstofferne i ’kælderen’ af det periodiske system, se figur 16. Her finder vi i øverste række lanthanoiderne, der faktisk burde være placeret efter lanthan i det periodiske system. Lanthanoiderne omfatter grundstofferne fra lanthan med atomnummer 57 til lutetium med atomnummer 71. Lanthanoidernes kemiske egenskaber minder om grundstoffet lanthan.
Actinoider, nederste række i det periodiske system i figur 16, burde på samme måde, være placeret efter grundstoffet actinium. Actinoiderne udgøres af grundstofferne actinium med atomnummer 89 til lawrencium nr. 103. En model af et periodisk system, hvor lanthanoiderne og actinoiderne er indsat, er vist i figur 22.
Actinoidernes kemiske egenskaber minder lidt om grundstoffet actinium. De fleste af actinoiderne er kunstige, og alle actinoiderne er radioaktive, så de er ikke så spændende kemisk set. Anderledes forholder det sig med lanthanoiderne, de er er sjove, siger Thomas. Hvorfor fortæller Thomas om lidt.

F-blokken og sjældne jordartsmetaller
Blokkene i det periodiske system henviser til de orbitaler, hvor valenselektronerne er. De grundstoffer, der udgør f-blokken, omfatter både lanthanoiderne og actinoiderne. I f-blokken og d-blokken, sker opfyldningen af elektroner lidt anderledes end i hovedgrupperne (s og p blokken), hvor opfyldningen af elektroner hen gennem en periode, sker i yderste skal.
Hen gennem rækken af lanthanoider i 6. periode, opfyldes 3. yderste elektronskal. Vi ser på to eksempler: fra lanthan til cerium, fyldes en elektron mere i 4 skal, som vist i figur 23
Det samme gælder for actinoiderne, hvor der sker en opfyldning 3. yderste skal, som er den 5. skal. Som vi så med d-blokken, gælder det også for f-blokken, at disse grundstoffers elektroner ikke er så interessant rent kemisk, da det ikke er de yderste elektronskaller, men derimod fx tredjeyderste skal. Lanthanoider optræder typisk som ioner, med ladningen +3, selvom det ikke lige kan ses ud fra elektronstrukturen i figur 23. Det er netop lanthanoidernes elektronstruktur, der giver dem de magnetiske og ’selvlysende’ egenskaber, du skal møde nedenfor.
Indimellem omtales lanthanoiderne og grundstofferne scandium og yttrium, også som de ’sjældne jordarter’, eller ’de sjældne jordartsmetaller’, men det er lidt misvisende, for de er hverken sjældne eller jordarter. Ligesom de fleste andre grundstoffer, forekommer lanthanoiderne aldrig som frit metal i naturen, men er derimod bundet i kemiske forbindelser i form af mineraler, som vist i figur 24.

Vidste du at…i smartphones og i fladskærme indgår lanthanoiderne, lanthan, praseodym, neodym, europium, gadolinium. Det betyder, at større efterspørgsel efter bl.a. smartphones, skaber en stigende efterspørgsel på netop disse grundstoffer.
De sjove grundstoffer
Tilbage til hvorfor lanthanoiderne er sjove. Thomas udtaler: ’ For mig er det mest fascinerende ved lanthanoiderne, deres evne til selv at udsende lys, når de er blevet lyst på – man siger i dagligsproget, at de er selvlysende, men det er lidt misvisende. Den tekniske term for denne egenskab er luminescens (Luminescens er et samlet begreb, der omfatter bla. fluorescense og phosphorescens), se figur 25.

Grundforskning
Thomas og resten af forskningsgruppen, laver grundforskning i grundstofferne i f-blokken, dvs. at de undersøger helt centrale og basale dele af disse grundstoffers kemi. For der er meget, man endnu ikke ved om disse grundstoffer og den kemi der fx udspiller sig, når lanthanoiderne er i opløsning. Thomas fortæller, at ’det for en naturvidenskabsperson svarer til at være opdagelsesrejsesende på et nyt og uudforsket kontinent. Det er i sig selv motivation nok til et livslangt studium.’
Heltene i kælderen.
Lanthanoiderne er i dag helt centrale, både i den teknologiske udvikling, i omstillingen til et mere bæredygtigt samfund, der ofte omtales som ’den grønne omstilling’ og i diagnosticering af forskellige sygdomme. Derfor omtaler Thomas dem som ’heltene i kælderen’.
Historier om grundstoffer
Det ligger Thomas på sinde at fortælle om grundstofferne. ’ Vi kan forklare så meget – hvis vi får lov. Hvorfor ser vores verden ud som den gør? Vidste du fx at vi først fik sand på jorden, da vi fik ilt i atmosfæren?’ spørger Thomas og fortsætter: ’Vi kan – og skal – fortælle en historie om grundstofferne’. Det er en af grundene til, at Thomas medvirker i en række podcasts, fx i ’Hva’ så ?! – forklarer alt’ med Christian Fuhlendorff.

Thomas er også med til at udvikle undervisningsforløb om kemi til Videnskabsklubben, og spillet om grundstoffernes periodiske system .
Anvendt forskning, spin-out firmaer og iværksætteri
Nogle gange er der ikke langt, fra grundforskning til anvendelse, det gælder også Thomas og resten af gruppens forskning i lanthanoiderne. Gadolinium anvendes i dag ifm. nogle typer af diagnosticering med MR scanning, hvor det bruges som kontrastvæske. Neodym indgår i stærke magneter, der bruges i vedvarende energikilder som bl.a vindmøller. Her indgår neodym typisk sammen med jern, som i forbindelsen Nd2Fe14B. Lanthanoiderne spiller også centrale roller i lys og displays, og endelig er de helt essentielle i kommunikation og IT. Lanthanoidet erbium er involveret i moderne datakommunikation, pga. de optiske egenskaber.
Thomas har på baggrund af sin forskning også udviklet en række firmaer (’start-ups’), der specialiserer sig i så forskellige elementer som fluorescerende farvestoffer, eller kemiske målemetoder, ved hjælp af sensorer.
Se mere
Målet er at træne den mundtlige formidling af et kemi fagligt emne. I skal formidle viden om et udvalgt grundstof. Oplægget er mundtligt og varer ca. 5 min. Til støtte for dit oplæg kan du lave en power point, Prezi eller andet. Men husk: det er indholdet, altså fagligheden – og ikke form – der er vigtigt her. Du bør vær så godt inde i dit emne, at du kan tale relativt frit. Gør dig umage. Vælg nogle gode og illustrative figurer. Alle figurer skal forklares. Til støtte for din fremlæggelse kan du udarbejde et talepapir, mens præsentationen (PPT, Prezi eller andet), kun indeholder stikord, figurer/filmklip oa. Oplægget holdes i matrix grupper.
Faglige Formalia: hvad der som minimum skal med i oplægget
(Det er ikke sikkert at I kan finde alt info, hvis ikke må i springe et enkelt punkt over)
Når ovenstående er besvaret kan I selv finde lidt yderligere information, der er bl.a. masser af info på Youtube.
I bør lave et talepapir. Talepapiret indeholder alt det faglige stof, du skal have med i dit oplæg.
Det er op til din lærer om der er frit valg af grundstof, eller om I skal vælg et grundstof fra listen, max. X personer pr. grundstof.
God arbejdslyst!
Se mere
Vi har spurgt forskellige studerende på Kemisk Institut, Københavns Universitet om, hvad deres favorit grundstof er og hvorfor. De fortæller også hvorfor de studerer det fag de gør, nemlig kemi eller medicinalkemi:
| Navn | Hvis du skulle vælge et favorit grundstof, hvad skulle det så være? | Hvorfor netop det grundstof? | Hvad studerer du og hvorfor? |
| Emil | Bismuth | Megaflotte krystaller | Kemi. Har altid syntes kemi er hyggeligt |
| Raf | Titan | Det er bare cool | Medicinalkemi. Fordi jeg gerne vil bekæmpe cancer |
| Thor | Carbon | Det er byggestenen for al organisk kemi | Kemi. Valgte studie samtidigt med Breaking Bad, syntes det var sjovt i gymnasiet |
| Kasper | Hydrogen | Det bliver overset, man tegner det ikke engang | Medicinalkemi. Kan lide organisk kemi |
| Josefine | Mangan | Har en flot farve I opløsninger | Kemi. Syntes det var spændende i gymnasiet og havde en supergod gymnasielærer |

Se mere
Nu har du mødt alle grundstofferne. Du har lært at deres placering i det periodiske system har betydning for deres kemiske egenskaber, og du kender til tilstandsformerne mm. Men grundstofferne er sjældent alene. De indgår typisk i kemiske forbindelser, hvor de danner de kemiske bindinger til hinanden, så de fysisk hænger sammen. Det kan du blive klogere på i afsnittet om kemiske bindingstyper .
6. Hvor kommer grundstofferne fra?
De naturligt forekommende grundstoffer (atomnummer 1-92 undtagen tecnetium, promethium, astat og francium) varierer meget i både, hvor hyppigt de forekommer og hvor.
Se mere
Langt størstedelen af de naturlige grundstoffer forekommer i jordskorpen. Meget få grundstoffer forekommer dog frit i jorden, og langt de fleste er bundet i kemiske forbindelser.
Grundstoffer er rene stoffer, der kun består af en slags atomer.
Kemiske forbindelser er rene stoffer sammensat af atomer fra mindst to forskellige grundstoffer.
Blandinger består af flere forskellige grundstoffer og/eller kemiske forbindelser.
Salte er ionforbindelser og er eksempler på kemiske forbindelser.
Molekyler er bundet sammen af elektronparbindinger. Nogle molekyler er kemiske forbindelser som fx vand H2O. Nogle få molekyler er rene grundstoffer, som fx molekylet dinitrogen N2.
Mineraler er et geologisk begreb og et hverdagsord, der beskriver faste stoffer, der har en nogenlunde veldefineret kemisk sammensætning, og er ordnet regelmæssigt i en krystalstruktur. Mange mineraler er salte.
Se mere
Se mere

I naturen findes de færreste grundstoffer frit. Derimod indgår atomer fra forskellige grundstoffer i en kemisk forbindelse og de skal derfor udvindes fra blandinger eller fra kemiske forbindelser.
Man taler ofte om råstoffer, som vi henter i naturen og udnytter i vores samfund. Råstoffer, der typisk er kemiske forbindelser, kan opdeles lidt forskelligt. Her opdeler vi i:
Se denne lille film
’Råstoffer- samfundets byggesten’. Råstoffer er vores civilisations byggesten, som kemiker på Københavns Universitet, Thomas Just Sørensen, udtaler i filmen. De mineralske råstoffer kan ikke dyrkes (modsat de biologiske råstoffer), og, ligesom de fossile brændstoffer, kan de ikke fornys inden for overskuelig tid. De mineralske råstoffer omtales ofte bare som mineraler. Mineraler er, som omtalt i boksen med faglige begreber, naturligt forekommende faste, uorganiske stoffer. Nogle mineraler er rene grundstoffer, andre er simple salte som fx køkkensalt NaCl, og atter andre er langt mere komplekse. Mineraler er dannet gennem geologiske processer.
Råstofferne er ikke jævnt fordelt globalt, og der er også helt forskellige mængder af de forskellige grundstoffer i jorden. Bemærk forskellen mellem råstof og grundstof. Et råstof, er typisk en kemiske forbindelse, der er sammensat af atomer fra flere forskellige grundstoffer. Kun meget få råstoffer er frie grundstoffer, som fx guld og diamant.
I det følgende er det grundstofferne, hvis atomer indgår i råstofferne, der er i fokus.
Grundstoffernes forekomst i jordskorpen hænger sammen med deres dannelse og med deres placering i det periodiske system. Generelt gælder det, at jo højere atomnummer, desto sjældnere er atomet, men med den tilføjelse, at atomerne med lige atomnumre er mere almindelige end grundstoffer med ulige atomnumre. Det kan man forklare ud fra, hvordan atomkernerne syntetiseres i stjernerne. Det samme, samt kernens meget store stabilitet, gælder den høje forekomst af jern (Fe). Selvom hyppigheden af grundstofferne i jordskorpen ikke er identisk med fordelingen i solsystemet, som er vist i figur 27, så er de overordnede tendenser de samme.
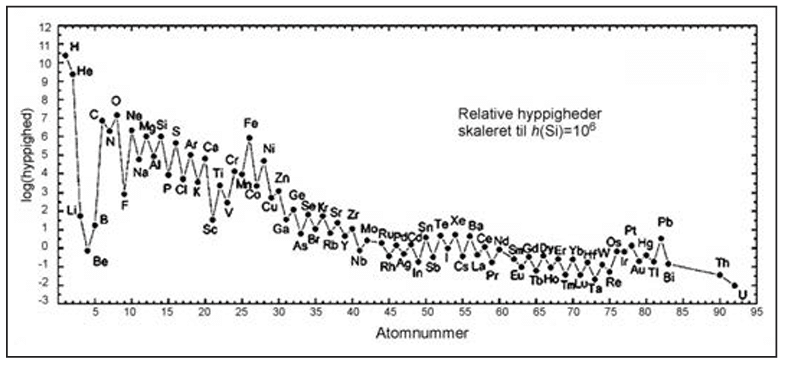
I takt med at vores samfund bliver mere udviklet (fra sten-, bronze og jernalderen, over landbrugssamfundet, til industrisamfundet og i dag et slags teknologisamfund) øges efterspørgslen på flere og flere grundstoffer. I jernalderen steg efterspørgslen på jern, senere, da vi opfandt elektricitet, steg efterspørgslen på kobber til el-ledninger, og i dag stiger efterspørgslen på bl.a. silicium, da det bruges i mikrochips og solceller. Også efterspørgslen på grundstoffer som neodym stiger, da det anvendes i magneter i både vindmøller og mobiltelefoner. Dette er illustreret i figur 28. Det er svært at sige, hvilke grundstoffer der efterspørges i fremtiden, men fremskrivninger viser, at for at imødekomme efterspørgslen, skal flere miner åbnes. Der er faktisk planer om at man i fremtiden vil lave ’urban mining’, hvor vigtige råstoffer sorteres fra vores affald som fx spildevand. For vi kan ikke nøjes med at genanvende os ud af det, da man forventer behovet vil stige, og der altid går noget tabt, ved genanvendelse. Men vi kan skaffe nye, da mange af metallerne stadig ligger i jordskorpen og ikke er udvundet endnu.
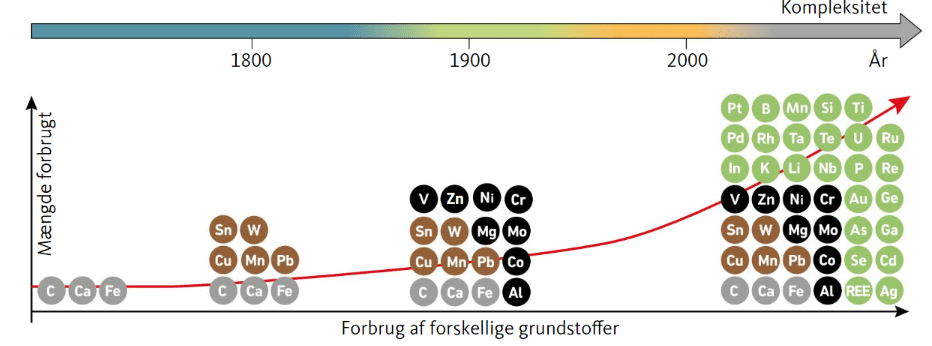
Sammenlign figur 27 om grundstoffernes forekomst, og figur 28 om forbrug af forskellige grundstoffer. Dokumenter med afsæt heri, hvad problemet er.
Se mere
7. Kritiske råstoffer
Råstofferne er en del af vores hverdag. De råstoffer, der har størst økonomisk betydning, og som har en høj forsyningsrisiko, kaldes kritiske råstoffer. EU’s liste over kritiske råstoffer (2023) indeholder mere end 34 forskellige råstoffer, se figur 29. Det er 4 mere end i 2020. Kritiske råstoffer er altså de råstoffer, som industrien har problemer med at skaffe, og som er umulige at undvære i produktionen til et moderne samfund. Når et råstof karakteriseres som kritisk, er det ikke nødvendigvis, fordi vi er ved at løbe tør for råstoffet, men fordi forsyningen til det enkelte land (eller union) ikke fungerer. Derfor er det vigtigt, at genanvende materialer fra kasserede produkter. På den måde kan forsyningen med et råstof bedres på en mere bæredygtig vis. Læg mærke til, at det ikke kun er metaller, der er kritiske råstoffer. Fx er både grundstoffet phosphor og den kemiske forbindelse phosphat på listen.

Gennemgå listen over kritiske råstoffer i figur 24.
Se mere
Phosphat (PO43-), som er på listen over kritiske råstoffer, kan genindvindes fra spildevand? Enten kemisk ved at udfælde det med jern-ioner eller biologisk ved hjælp af bakterier, som optager phosphat og indbygger det i en form, der nemmere kan genanvendes senere?
Både grundstoffet phosphor og ionen phosphat er blandt de kritiske råstoffer, som det fremgår af figur 29. I spildevandcentre kan man binde phosphat enten kemisk eller biologisk, så det ikke udledes til vandmiljøet. Her kan det nemlig føre til næringsstofberigelse (såkaldt eutrofiering), der giver massiv algevækst og i sidste ende kan føre til iltsvind.
Kemisk fældning af phosphat i spildevandscentret, sker ofte ved at lade phosphat-ioner reagere med jern-ioner (på ’kemisprog’ jern (3+)-ioner) i spildevandscentret, som reaktionsskema 2) nedenfor viser
Fe3+ (aq) + PO43- (aq) → FePO4 (s)
(2)
På den måde bindes phosphat fra vandet og bliver til fast stof (med det kemiske navn jern(3+)phosphat). Men fordi jern og phosphat binder så godt til hinanden, bliver tilgængeligheden af phosphat lav, hvilket gør det svært at genanvende phosphat herfra. Derfor er man begyndt på biologisk fjernelse af phosphat, der gør det nemmere at genanvende phosphat.
Ved at lade særlige bakteriestammer optage opløst phosphat, og derved binde en stor del af spildevandets phosphat biologisk, oplagres lange kæder af phosphat, kaldet polyphosphat i bakterierne.
Herefter kan det udvindes og forarbejdes med henblik på at genindvinde phosphat og benytte det til fx. gødning eller som råstof i industrien. Netop genanvendelse spiller en central rolle i bæredygtighed.
Alle de mineralske råstoffer, vi er så afhængige af i teknologi, nogle typer af medicin og i den grønne omstilling, er på et tidspunkt blevet udvundet ved minedrift et sted på jorden, som er i fokus i næste afsnit. Efterfølgende er de blevet oprenset og forarbejdet for at blive til de råvarer, der indgår i alverdens produkter.
Minedrift er en sjældenhed i Danmark i dag. Tidligere har der fx været en aktiv kalkmine i Thingbæk i Jylland som omtalt i faktaboksen nedenfor, og på Stevns på Sjælland. I dag er der stadig aktive kalkbrud (åbne miner) i fx Faxe på Sjælland, hvor man udvinder kalk, som omtalt i faktaboksen nedenfor, og vist i figur 30.

På jordens overflade findes rigtig meget calcium i primært to forskellige kemiske forbindelser. Den ene er calciumsilicat, som dækker over forskellige forbindelser mellem grundstofferne calcium, silicium og oxygen. Den anden er kalk, også kaldet calciumcarbonat (CaCO3), der indeholder grundstofferne calcium, carbon og oxygen. Det meste af den kalk, vi finder på jorden bl.a. i Danmark ved Møns Klint og Dalbyover kalkgrave, er dannet ved biomineralisering, dengang Danmark lå under havets overflade. Det betyder, at levende organismer engang for længe siden har produceret kalken. Du kender mange organismer, der laver biomineralisering af kalk. Alle muslingeskaller, sneglehuse, koraller m.m. består af kalk, og det har to funktioner: Dels en beskyttelse mod rovdyr, og dels giver kalken en afstivning af organismen – en form for skelet, der sidder udenpå organismen, se figur 31a.
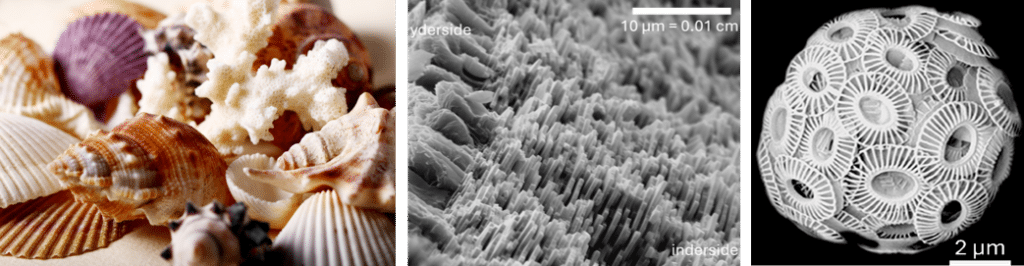
Også planter biomineraliserer kalk som fx kokkolitten, der er en encellet type alge. Hos planten sker biomineraliseringen af skjoldformede kalkplader rigtig hurtigt inden i cellen, hvorefter de smides ud af cellen og sætter sig fat udenpå, se figur 31b. Denne kokkolit-dannelses video er optaget over 8 timer, hvor algecellen laver de små kalkplader. Kokkolitter udgør hovedparten af kalkaflejringer i naturen (skrivekridt). Der er rigtig mange kokkolitter i verden – så meget, at når der sker opblomstring af dem i havet, kan man se det fra rummet! Og du er tættere på en biomineraliserende organisme, end du tror. Du biomineraliserer nemlig også selv, når din krop laver knogler og tænder, men du er ikke lige så hurtig som kokkolitten! Alligevel er dine knogler fantastiske! Det er de, fordi de både er lette og har stor stivhed.

Henrik siger: ”Knogler består af et kompositmateriale, dvs. et materiale, der består af to eller flere forskellige materialer, der er pakket ind imellem hinanden, lidt som et indre Eiffeltårn, og giver materialet en ny egenskab. I knogler er det anden calciumforbindelse, apatit (Ca5(PO3)6(OH)), der udgør den stive del af knoglen, og proteinet collagen, der giver knoglen elasticitet. Uden kollagen, ville knoglen være skrøbelig og knække let, og uden calciumforbindelserne ville knoglen være bøjelig, og dit skelet ville ikke kunne holde dig oprejst.”
En materialekemiker studerer hvordan materialer med interessante egenskaber er sammensat, og som måske kan bruges i nye sammenhænge. Ved at studere naturens materialer er forskere lykkedes med at lave materialer, der kan reparere sig selv, er superglatte så ingen organismer kan gro på dem eller som kan programmeres til at ’tænke selv’.
Se mere
Gustave Eiffel blev inspireret af strukturen af lårbensknoglen hos mennesker, da han byggede Eiffeltårnet?
Tilbage i 1840 var der også en kulmine på Bornholm, men i dag har vi ikke længere egentlig minedrift i Danmark. Der er alligevel stor råstofudvinding i form af grus (grusgrave), mange steder i hele landet, ligesom der også på Bornholm er granitbrud. Figur 32 viser en oversigt over, hvilke typer af råstoffer, vi udvinder i Danmark, på land.
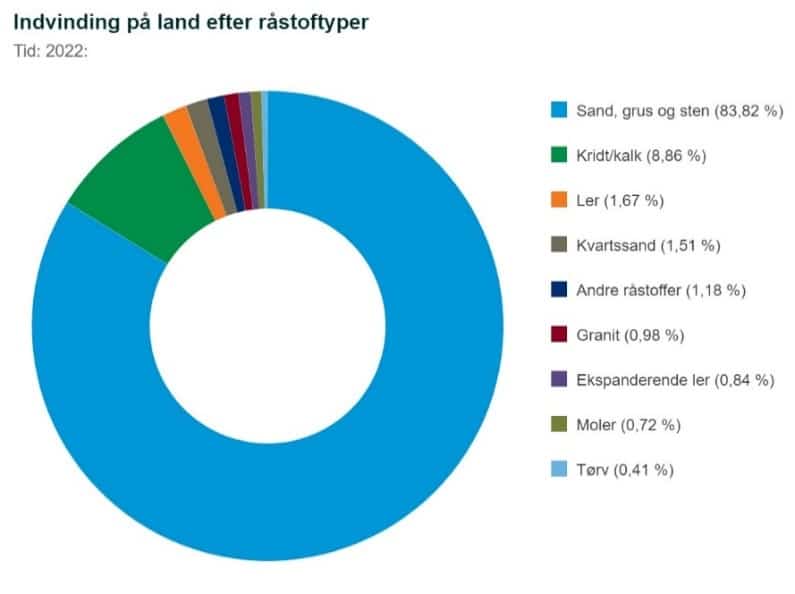
Danmarks undergrund indeholder ikke særlige forekomster af metaller, da det meste af Danmark ligger oven på gammel havbund, og det er også en grund til at vi ikke har egentlige miner, modsat vores naboland Sverige. Også Grønland har store forekomster af visse metaller. Minedrift er forudsætningen for, at vi kan få de råmaterialer vi har brug for. Som geolog Kristoffer Szilas udtaler: ”Hvis ikke man kan dyrke de råmaterialer, vi anvender i samfundet – så som træ, bomuld og så videre – så kommer det med andre ord fra en mine et sted ude i verden. Og behovet for minedrift har aldrig været større, end det er i dag. Skal vi i mål med den grønne omstilling, kræver det nemlig langt flere metaller og mineraler, end vi udvinder i dag".
Størstedelen af de mineralske råstoffer, der er nødvendige i et moderne samfund udvindes ved minedrift og forarbejdes uden for EU. Fx udvindes 63 % af verdens cobalt i det afrikanske land DR Congo (Se evt. mere her om i temaet Fremtidens batterier her). For magnesium gælder at 97 % af EU’s forbrug stammer fra Kina. De grundstoffer, der omtales som de tunge sjældne jordarter (de tunge sjældne jordarter omfatter grundstofferne 64-71) , forarbejdes alle i Kina og Kina sidder derfor på 100% af forsyningen af disse. Det er et geopolitisk problem og kan skabe problemer med forsyningen, for så har de enkelte lande (eller unioner som EU), ikke selv kontrol over råstoffernes udvinding, distribution (fordeling) eller pris. Hvor de kritiske råstoffer kommer fra, er vist i figur 33.
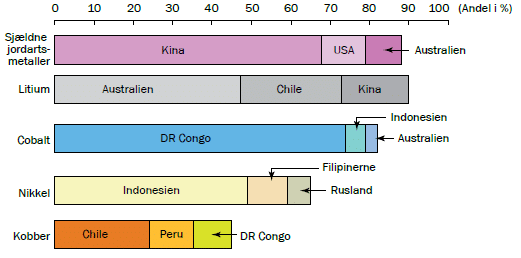
Men hvordan udvindes råstofferne egentlig ved minedrift? Og hvilke konsekvenser har det for miljøet? Det kan du læse om i faktaboksen ’Nikkelminer i Indonesien’.

Nikkel er et overgangsmetal med atomnummer 28. Det er et sølvhvidt hårdt metal, anvendes i bl.a. rustfrit stål. Nikkel bruges også i mobiltelefonens og elbilens batterier. I dag kommer langt det meste nikkel fra minedrift i Indonesien, se figur 33. Nikkel findes kun i små mængden i jordskorpen, men i lidt højere koncentrationer i tropiske områder som Indonesien.
Her, i Indonesiens skønne natur med både regnskov og havet med koralrev, forekommer nikkel i de øverste jordlag i særlige nikkelholdige mineraler som garnierit. Man kan angive den tilnærmede og lidt komplekse formel for garnierit som (Ni,Mg)3Si4O10(OH)2, se figur 35. Her er nikkelindholdet omkring 1 %, så der er en del forarbejdning, før man har et produkt, der består af næsten rent nikkel. Faktisk indgår også en smule cobalt (ca. 0,03%) i mineralet garnierit, selvom det ikke fremgår af den angivne kemiske formel. Derfor er der som biprodukt fra nikkelproduktion, også produktion af metallet cobalt i mindre mængder.

Det er typisk åbne nikkelminer i Indonesien, og her er et af de første trin i udvindingen af nikkel, at det øverste jordlag behandles med svovlsyre, hvorfra nikkel kan ekstraheres. Tilbage er en stor rest, som man ikke kan dyrke noget i. Nikkelforbindelser, der er blevet udvundet med syre, skal efterfølgende forarbejdes og raffineres, før de bliver til metallisk nikkel.
Nikkel udvindes under elendige og uetiske arbejdsforhold. For at udvinde nikkel fra jorden ryddes desuden regnskov, se figur 34. Nikkelminer er hovedårsagen til afskovning i Indonesien i 2024. Nikkelminerne forurener også havet omkring, for når det regner, føres noget af sedimentet fra minernes åbne brud ud i havet, hvor det påvirker både fiskebestanden og de lokale indbyggere.
Som geolog Kristoffer Szilas udtaler: ’vi har outsourcet problemerne til andre lande, og det har fatale konsekvenser for disse landes natur og kultur’, som klippet her om nikkelminer i Indonesien og dets påvirkning af miljøet viser.
Minedriften I Indonesien, men også andre steder, kan ledsages af forurening, og foregår ofte under dårlige arbejdsforhold. Så når der skal åbnes flere miner i fremtiden, bør der være større fokus på bæredygtighed. Både, den social bæredygtighed, den miljømæssig bæredygtighed, og også den økonomiske bæredygtighed, for at det skal være økonomisk rentabelt at lave bedre minedrift.
Nikkel er et af de kritiske råstoffer og indgår i mange typer genopladelige batterier. Nikkel er allergifremkaldende, og giftigt i høje koncentrationer, så af mange årsager kan det være smart i fremtiden fx at undgå batterier med nikkel. Heldigvis er nikkel et af de metaller, man er blevet bedre til at genanvende, som vi ser på senere.

Se mere
Læs faktaboksen om nikkel og mindrift, og svar så godt du kan på:
Se mere
der i den Nordsvenske by Kiruna, er gjort et kæmpe fund af metaller, der er særligt vigtige i teknologi og i den grønne omstilling, nemlig lanthanoiderne? De indgår i det man ofte kalder ’de sjældne jordarter’. Fundet er gjort af det svenske mineselskab LKAB, og er formentlig det største europæiske fund af disse metaller nogensinde.
9. Grundstoffer og bæredygtighed
Vores moderne livsstil, grøn teknologi og ny medicin skaber behov for flere grundstoffer og for nogle andre grundstoffer, end dem der tidligere har været behov for. Som omtalt i faktaboks om minedrift af nikkel, foregår meget udvinding i dag på en måde, der hverken er socialt, økonomisk eller miljømæssigt bæredygtigt. Men med øget opmærksomhed på netop bæredygtighed, kan dette ændre sig i fremtiden.
Bæredygtighed er som nævnt tidligere et bredt begreb, der også involverer miljø og klima. Men hvordan måler man egentlig bæredygtighed? Om noget er mere eller mindre bæredygtigt? Der er mange måder at måle både bæredygtighed og klimaindsatser på. Måske du har hørt om klimaaftryk, eller CO2–udledning, som mål for klimaindsatser. En lidt anderledes mål for bæredygtighed, er ’World overshoot day,’ altså dagen, hvor ressourcekontoen er tom (en slags ressourceoverskridelsesdag). Ressourcekontoen viser, hvornår på året, hele årets mængde af ressourcer er brugt. Med ressource menes alle typer af råstoffer (både metaller, fødevarer, grus mm) og den kan angives globalt, eller pr. land, virksomhed eller enkeltperson.
Ressourcekontoen er lidt som en bankkonto. Når der er 0 på ressourcekontoen, er der ved årets udgang, brugt lige som mange råstoffer på et år, som der er. Når der er – på ressourcekontoen, er der brugt flere råstoffer, end der kan nå at blive gendannet på et år, og tallet markerer så, hvornår disse ressourcer er opbrugt. ’World overshoot day,’ markerer altså den dag på året, hvor hele årets mængde af råstoffer er brugt.

Hvis World overshoot day er d. 31/12 er ressourcekontoen i 0. Ligger dagen før d.31/12 er ressourcekontoen i minus.
Se mere
Danmark ligger i bund, hvad angår bæredygtighed, målt som World overshoot day (den nationale ’ressourceoverskridelsesdag’), som er den dag på året, hvor hele årets mængde af ressourcer er brugt? Så det er de rigeste lande herunder Danmark, der ligger i bund, hvad angår bæredygtighed.
Så hvad er bæredygtige grundstoffer? Først skal vi lige præcisere: Grundstofferne i sig selv er hverken mere eller mindre bæredygtige. Det er vores brug af grundstofferne, der kan være mere eller mindre bæredygtig. Figur 37 viser en alternativ udgave af det periodiske system. Figur 29 viser de grundstoffer, der findes på listen over kritiske råstoffer, og dermed hvilke grundstoffer, der er er svære at skaffe på bæredygtig vis.
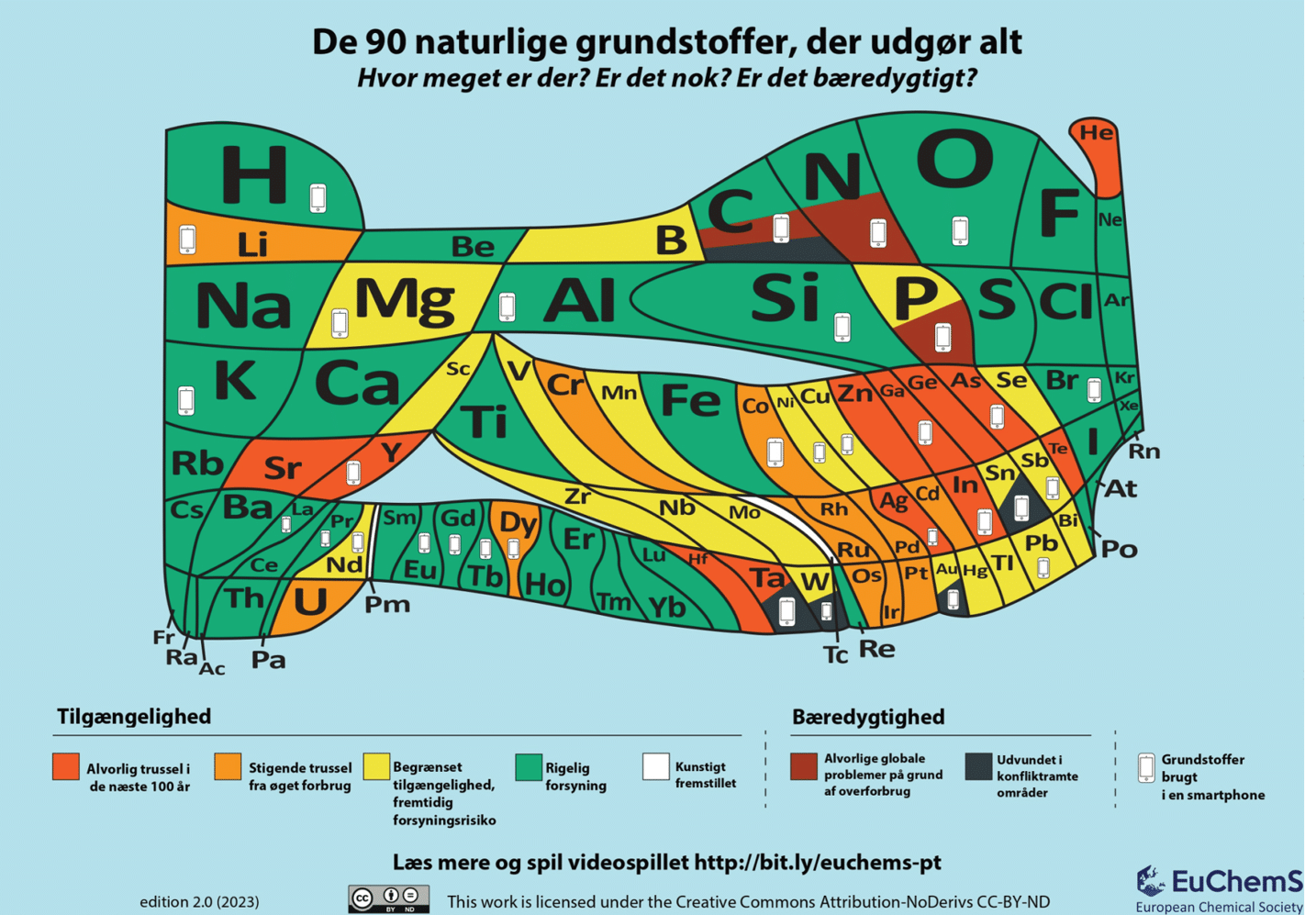
Kig på figur 37. Sammenlign med det almindelige grundstoffernes periodiske system.
Hvad er der af forskelle og ligheder? Hvorfor mon figur 37 viser nogle grundstoffer større end andre?
Se mere
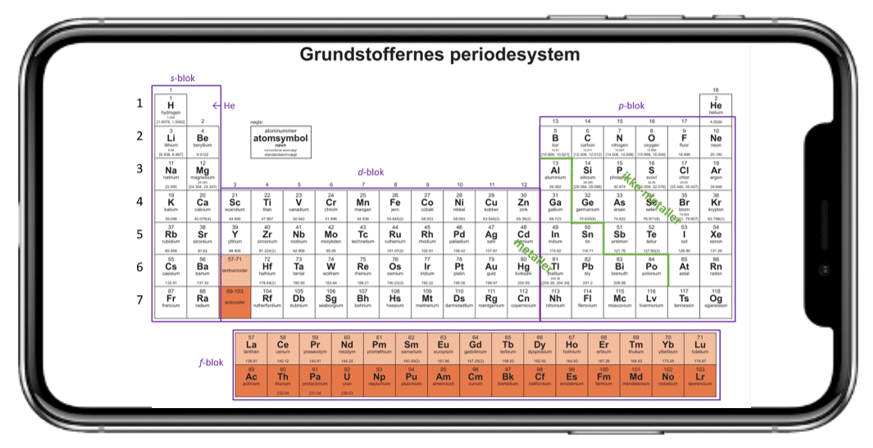
Der bruges omkring 60 forskellige råstoffer i din mobiltelefon. I opgave 21 og 22 ser vi nærmere på, hvilke råstoffer herunder grundstoffer det er, du kender sikkert nogle af dem allerede.
En bæredygtig udvikling opfylder de nuværende behov, vi mennesker har, uden at bringe fremtidige generationers muligheder for at opfylde deres behov i fare. Det indebærer, at vi ikke kan fortsætte i samme grad med at forbruge de grundstoffer, der er markeret med rødt eller mørk orange i figur 37. Der er derfor problemer med bæredygtig brug af nogle af de grundstoffer der indgår i en smartphone. Så nej, helt bæredygtig er en almindelig smartphone ikke, dette ser vi nærmere på i opgave 22 og 23
Hvilke grundstoffer, tror du, forekommer i din mobiltelefon?
Overvej selv eller i små grupper, hvilke grundstoffer du/I mener indgår i mobiltelefonen. Det handler ikke om at svaret er helt korrekt, men om at tage afsæt i den egen forforståelse.
Se mere
Testoteket (Astra) har lavet dette lille filmklip på 5 min. om grundstoffer i smartphones. Det viser, hvilke grundstoffer der indgår i din mobiltelefon, og hvordan man kan illustrere det. Se eller gense også filmen ’Råstoffer- samfundets byggesten”, du kan nøjes med at se 2,5 minut, fra 10.00-12.50 min.
Se mere
Vi kommer ikke udenom at kigge på vores forbrug, når vi skal nå klimamål og være mere bæredygtige. Danskerne er ’mestre’ i forbrug af tøj og elektronisk udstyr. Nyt tøj, ny computer, ny smartphone, nyt tv, ny elbil… Fortsæt selv listen. Vi påvirkes på mange måder til at tro, at vi bare MÅ eje den sidste nye version af telefonen. Men det er langt fra bæredygtigt.
hver husstand herhjemme i gennemsnit har 45 kilo elektronik, som ikke har været i brug i mindst et år?
Vi skal lige have et par begreber på plads, som vi ikke altid skelner mellem, nemlig genanvendelse og genbrug. Genbrug er, når et produkt bruges til det samme, fx genbrugstøj. Processen, hvor et produkt inddrages i en ny produktion af et nyt eller andet produkt, omtales som genanvendelse. Hvis fx ølflasken, når den er for slidt til at blive genbrugt, indgår i produktionen af nye glasflasker, er det genanvendelse.
Det går den forkerte vej med danskernes forbrug, som avisoverskriften her fortæller ’Nu ligger danskerne helt i top i EU med klimabelastende forbrug’ (kilde Information 1/3 2024) . Heldigvis går det faktisk den rigtige vej, både herhjemme og på verdensplan ift. genanvendelse. Alle kommuner i Danmark skal sortere affald i minimum ni fraktioner: mad, papir, pap, glas, metal, plast, mad- og drikkekarton, restaffald og farligt affald. Ser vi nærmere på genanvendelse af metaller, viser det sig, at vi er særligt gode til at genanvende aluminium. Aluminium indgår i mange ting, fx alufolie, øldåser og også biler. Tal viser, at ca. 75 % af al aluminium, der nogensinde er produceret, stadig er i brug. Det kan fx sammenlignes med beskedne 6 % for al plast. Så når først aluminium er udvundet af mineralet bauxit, kan det genanvendes igen og igen.
For nikkel anslås det, at mellem 25-50 % nikkel bliver genanvendt, mens 45 % af det samlede nikkelforbrug i USA stammer fra genanvendelse.
Men genanvendelse er også ofte svær. Det er nemmere at skille rene metaller (grundstoffer) fra fx en kobberledning, end det er skille en blanding af metaller fra hinanden (kemiske forbindelser), som i legeringer, der findes i bl.a. batterier. Det kræver både meget energi og en række kemikalier. Derfor er der også forskel på, hvor god man er til at genanvende forskellige metaller, som det er vist i figur 38.
Se mere
Så kommer det store spørgsmål: Kommer vi til at løbe tør for kritiske råstoffer, herunder visse metaller i fremtiden ? Det korte svar er nej. Dels bliver vi bedre til at genanvende og dels finder vi hele tiden nye forekomster af råstofferne. Og sådan er vi tilbage, hvor vi startede. Alt omkring os er kemi. Luften du indånder, dig selv, din telefon og dit affald er alt sammen kemi.

Ekstra materiale